Внутрь, в любое время суток, без предварительного приема слабительных, не обязательно натощак.
Таблетки предназначены для взрослых и детей старше 6 лет.
Детям младше 6 лет рекомендуется только суспензия. Суспензия предназначена для детей массой тела более 12 кг. Суспензию перед употреблением взбалтывать.
1 мл суспензии содержит 50 мг пирантела основания, 1 мерная ложка (2,5 мл) — 125 мг пирантела основания.
Острицы и аскариды: при лечении энтеробиоза и аскаридоза препарат назначают однократно в рекомендуемой дозе.
Обычная дозировка — 12,5 мг/кг однократно:
— детям младше 6 лет — 1 мерная ложка суспензии на 10 кг массы тела;
— детям старше 6 лет — 1 мерная ложка суспензии или 1 табл. 125 мг на 10 кг массы тела;
— взрослым массой тела менее 75 кг — 6 мерных ложек или 6 табл. по 125 мг, или 3 табл. по 250 мг;
— взрослым массой тела более 75 кг — 8 мерных ложек суспензии или 8 табл. по 125 мг, или 4 табл. по 250 мг.
Для профилактики повторного заражения рекомендуется повторить прием препарата через 3 нед.
Анкилостомы: в зонах эндемии, в случае заражения Necator americanus или тяжелого заражения Ankylostoma duodenale — 25 мг/кг/сут (в 1 или 2 приема) в течение 2–3 дней:
— детям — 250 мг на 10 кг массы тела ежедневно;
— взрослым массой тела менее 75 кг — 1,5 г в день;
— взрослым массой тела более 75 кг — 2 г в день.
В случае заражения Ankylostoma duodenale вне зон эндемии (протекает более легко) — в дозе 12,5 мг/кг за 1 прием.
Инструкция по применению Котеллик 20 мг 63 шт. таблетки
Форма выпуска, упаковка и состав препарата
Таблетки, покрытые пленочной оболочкой белого цвета, круглые, двояковыпуклые; на одной стороне таблетки гравировка «COB».
1 таб. |
|
кобиметиниб (в форме кобиметиниба гемифумарата) |
20 мг (22.2 мг) |
Вспомогательные вещества: лактозы моногидрат, кроскармеллоза натрия, целлюлоза микрокристаллическая, магния стеарат.
Состав пленочной оболочки: поливиниловый спирт, титана диоксид (Е171), макрогол, тальк.
21 шт. — блистеры (3) — пачки картонные×.
× с целью контроля первого вскрытия на упаковку наносится защитная голографическая наклейка.
Фармакологическое действие
Механизм действия
Путь митоген-активируемой протеинкиназы МАРК (Mitogen-Activated Protein Kinase)/внеклеточной сигнал-регулируемой киназы ERK (Extracellular signal Regulated Kinase) является основным путем передачи сигнала, который регулирует пролиферацию клеток, клеточный цикл, выживаемость клеток, ангиогенез и миграцию клеток.
Препарат Котеллик® — высокоселективный аллостерический ингибитор киназ МЕК1/2 (MAPK/ERK Kinase) для приема внутрь. В биохимических и цитологических исследованиях кобиметиниб продемонстрировал высокую ингибирующую способность, а также активность в отношении широкого спектра опухолей in vivo на моделях ксенотрансплантата опухолей, включая опухоли, несущие мутации BRAF и KRAS. В биохимических и структурных исследованиях было показано взаимодействие кобиметиниба с МЕК, с незначительной чувствительностью к динамическим конформационным изменениям, наблюдаемым при переходе МЕК в фосфорилированную форму. Как результат, кобиметиниб сохраняет связывающую способность и ингибирующую активность при фосфорилировании МЕК. Кобиметиниб показал наиболее высокую активность в отношении линий опухолевых клеток и опухолей с высокими уровнями фосфорилирования МЕК, что часто наблюдается в опухолях с мутациями BRAF.
В доклинических исследованиях обработка кобиметинибом МАРК-дисрегулированных опухолевых клеток и опухолей приводит к фосфорилированию киназ ERK1/2, единственных известных субстратов МЕК1/2.
Передача сигнала по МАРК-пути зависит от активности киназ ERK1/2, которые фосфорилируют белковые мишени в цитоплазме и ядре, в свою очередь индуцирующие прогрессирование клеточного цикла, пролиферацию клеток, выживаемость и миграцию клеток. Таким образом, кобиметиниб противодействует промитогенной и онкогенной активности, индуцируемой через МАРК-путь, за счет ингибирования МЕК1/2.
При приеме препарата Котеллик® в комбинации с вемурафенибом (мишенью которого является измененный белок BRAF) рост злокачественной опухоли еще больше замедляется или совсем прекращается.
Комбинация вемурафениба и препарата Котеллик® ингибирует реактивацию МАРК-пути через МЕК1/2 за счет одновременного воздействия на BRAF и МЕК, приводя к более выраженному подавлению передачи сигналов, апоптозу большего числа опухолевых клеток и усилению опухолевых ответов в доклинических моделях по сравнению с монотерапией вемурафенибом.
Доклинические данные по безопасности
Канцерогенность. Исследования канцерогенности кобиметиниба не проводились.
Мутагенность. Стандартные исследования генотоксичности дали отрицательные результаты.
Удлинение интервала QT. В условиях in vitro кобиметиниб вызывает умеренно выраженное ингибирование ионного hERG-канала (концентрация, необходимая для ингибирования hERG-канала (IC50) = 0.5 мкМ [266 нг/мл]), что приблизительно в 18 раз больше, чем Cmax в плазме крови при применении в дозе 60 мг (Сmax несвязанного препарата = 14 нг/мл [0.03 мкМ]).
При лечении пациентов препаратом Котеллик® в комбинации с вемурафенибом не отмечалось дополнительного клинического влияния на удлинение интервала QT.
Оценка общей токсичности. В исследованиях токсичности у крыс и собак были выявлены в целом обратимые дегенеративные изменения в костном мозге, ЖКТ, коже, тимусе, надпочечниках, печени, селезенке, лимфатических узлах, почках, сердце, яичниках и влагалище при экспозиции в плазме ниже клинически эффективного уровня.
Доклинические исследования не выявили специфических рисков для человека (на основании результатов стандартных фармакологических исследований по безопасности и генотоксичности).
Фармакокинетика
Всасывание
При приеме кобиметиниба в дозе 60 мг у пациентов с онкологическими заболеваниями отмечается умеренная скорость всасывания с медианой времени до достижения максимальной концентрации в плазме крови (Тmax) 2.4 ч. Средние показатели Сmax в равновесном состоянии и AUC0-24 составляют 273 нг/мл и 4340 нг×ч/мл соответственно. Среднее значение коэффициента накопления в равновесном состоянии составляет приблизительно 2.4.
Кобиметиниб обладает линейной фармакокинетикой в диапазоне доз от приблизительно 3.5 мг до 100 мг.
Абсолютная биодоступность кобиметиниба у здоровых лиц составляет 45.9%. У здоровых лиц было показано, что кобиметиниб интенсивно метаболизируется и выводится через кишечник. Степень всасывания составляет приблизительно 88%, что указывает на высокий уровень всасывания и пресистемный метаболизм.
Фармакокинетика кобиметиниба не изменяется при приеме препарата с пищей (в т.ч. с высоким содержанием жиров) по сравнению с приемом натощак у здоровых лиц. Поскольку пища не влияет на фармакокинетику кобиметиниба, препарат можно принимать независимо от приема пищи.
Распределение
Связывание кобиметиниба с белками плазмы in vitro составляет 94.8%. При этом не наблюдается преимущественного связывания с эритроцитами человека (соотношение кровь-плазма 0.93).
Vd у здоровых лиц, получивших кобиметиниб в дозе 2 мг (в/в), составляет 1050 л. По данным популяционного фармакокинетического анализа кажущийся Vd у онкологических больных составляет 806 л.
Метаболизм
Соотношение кобиметиниба и его метаболитов было изучено в ходе исследования массового баланса у здоровых лиц.
В среднем, 94% дозы восстанавливается в течение 17 дней. Кобиметиниб интенсивно метаболизируется и выводится через кишечник; при этом не отмечается преобладания ни одного из метаболитов.
Основные пути метаболизма кобиметиниба — окисление с помощью изофермента CYP3A и глюкуронирование с помощью изофермента UGT2B7. Кобиметиниб является основным веществом, выявляемым в плазме крови. Доля окисленных метаболитов в плазме крови составляет не более 10% от общего числа циркулирующей радиоактивности, при этом специфических для человека метаболитов не выявлено.
Доля неизмененного препарата в кале и моче составляет 6.6% и 1.6% от введенной дозы соответственно, что указывает на то, что кобиметиниб преимущественно подвергается метаболизму и в незначительном количестве выводится почками. Данные in vitro показывают, что кобиметиниб не является ингибитором ОАТ1, ОАТЗ или ОСТ2.
Выведение
После в/в введения кобиметиниба в дозе 2 мг средний клиренс составляет 10.7 л/ч. Средний кажущийся клиренс у онкологических больных после приема кобиметиниба в дозе 60 мг составляет 13.8 л/ч.
Средний Т1/2 кобиметиниба составляет 43.6 ч (диапазон от 23.1 до 69.6 ч).
Фармакокинетика у особых групп пациентов
По данным популяционного фармакокинетического анализа пол, раса, этническая принадлежность, исходная оценка по ECOG, а также легкое и умеренное нарушение функции почек не влияют на фармакокинетику кобиметиниба.
Статистически значимыми ковариантами для клиренса и Vd кобиметиниба являются возраст и масса тела соответственно. Однако согласно результатам анализа чувствительности ни одна из этих ковариант не оказывает клинически значимого влияния на экспозицию в равновесном состоянии.
Пол. По данным популяционного фармакокинетического анализа пол не оказывает влияния на экспозицию кобиметиниба.
Пациенты пожилого возраста. По данным популяционного фармакокинетического анализа возраст не оказывает влияния на экспозицию кобиметиниба.
Пациенты с нарушением функции почек. По данным доклинических исследований и исследований массового баланса кобиметиниб преимущественно подвергается метаболизму с минимальным выведением почками. Специальные исследования фармакокинетики кобиметиниба у пациентов с нарушением функции почек не проводились. Согласно результатам популяционного фармакокинетического анализа данных у пациентов с легким и умеренным нарушением функции почек, а также у пациентов с нормальной функцией почек (КК ≥90 мл/мин) КК не оказывает значимого влияния на экспозицию кобиметиниба. По данным популяционного фармакокинетического анализа нарушение функции почек легкой и средней степени тяжести не влияет на экспозицию кобиметиниба. Недостаточно данных для определения необходимости в коррекции дозы у пациентов с тяжелым нарушением функции почек.
Пациенты с нарушением функции печени. Фармакокинетику кобиметиниба оценивали у пациентов с легким нарушением функции печени (класс А по шкале Чайлд-Пью), пациентов с умеренным нарушением функции печени (класс В по шкале Чайлд-Пью), пациентов с тяжелым нарушением функции печени (класс С по шкале Чайлд-Пью) и у здоровых лиц. У пациентов с легким или умеренным нарушением функции печени по сравнению со здоровыми лицами системная экспозиция после применения однократной дозы кобиметиниба была сходной. У пациентов с тяжелым нарушением функции печени отмечались более низкие экспозиции кобиметиниба (среднее геометрическое соотношение AUC0-∞ составляет 0.69 по сравнению со здоровыми лицами). Данное явление не считается клинически значимым. Таким образом, пациентам с нарушением функции печени при применении препарата Котеллик® коррекция дозы не рекомендуется.
Показания
неоперабельная или метастатическая меланома с BRAF V600 мутацией у взрослых пациентов в комбинации с вемурафенибом.
В обзоре приведен анализ результатов ключевых исследований, в которых оценивалась эффективность и безопасность препаратов кобиметиниб (Котеллик) и вемурафениб (Зелбораф) как в составе комбинированной терапии, так и в качестве монопрепаратов для пациентов с меланомой кожи. В ключевом исследовании coBRIM ранее не получавшие лечение пациенты с меланомой кожи IIIC или IV стадий заболевания и наличием мутации в гене BRAF V600, получали комбинированную терапию кобиметиниб+вемурафениб или вемурафениб в монорежиме. Показано достоверное преимущество комбинации кобиметиниба с вемурафенибом: увеличение времени без прогрессирования, общей выживаемости, частоты объективных ответов. Профиль токсичности комбинации кобиметиниба и вемурафениба был приемлемым и управляемым. Таким образом, комбинированная терапия кобиметинибом в сочетании с вемурафенибом обладает высоким терапевтическим потенциалом и является новым стандартом лечения пациентов с метастатической меланомой с наличием мутации в гене BRAF V600.
Режим дозирования
Препарат Котеллик® применяется только в комбинации с вемурафенибом.
Лечение препаратом Котеллик® должен начинать и контролировать врач, имеющий опыт лечения пациентов с онкологическими заболеваниями.
Перед применением препарата Котеллик® в комбинации с вемурафенибом следует провести валидированный тест на наличие BRAF V600 мутации.
При применении препарата Котеллик® в комбинации с вемурафенибом следует изучить также инструкцию по медицинскому применению вемурафениба.
Препарат принимают внутрь. Каждую дозу (3 таб. по 20 мг на один прием) можно принимать независимо от приема пищи. Таблетки следует проглатывать целиком, запивая водой.
Рекомендуемая доза препарата Котеллик® составляет 60 мг (3 таб. по 20 мг) 1 раз/сут.
Препарат Котеллик® необходимо принимать 28-дневными циклами. Каждая доза препарата состоит из 3 таб. по 20 мг (60 мг), и ее следует принимать 1 раз/сут в течение 21 дня (период лечения с 1 по 21 день) с последующим 7-дневным перерывом в лечении препаратом Котеллик® (перерыв в лечении с 22 по 28 день).
Продолжительность лечения
Лечение препаратом следует продолжать до тех пор, пока сохраняется польза для пациента или до развития непереносимой токсичности.
Задержка приема или пропущенные дозы
В случае если до приема следующей дозы осталось 12 ч и более, следует принять препарат Котеллик® с целью сохранения схемы лечения с приемом 1 раз/сут. Если до приема следующей дозы осталось менее 12 ч, лечение следует продолжить на следующий день согласно назначенной схеме.
Рвота
В случае возникновения рвоты после приема препарата Котеллик® не следует принимать дополнительную дозу препарата в тот же день, следует продолжить лечение согласно назначенной схеме на следующий день.
Изменение дозы
Изменение дозы препарата Котеллик® должно основываться на оценке лечащим врачом безопасности и переносимости препарата у конкретного пациента.
Если пропуск дозы связан с появлением токсичности, пропущенные дозы не следует восполнять.
После снижения дозы препарата в дальнейшем не следует вновь повышать дозу. Изменение дозы препарата Котеллик® не зависит от изменения дозы вемурафениба. Решение об уменьшении дозы одного или обоих препаратов должно быть основано на клинической оценке.
В таблице 1 приведены общие рекомендации по изменению дозы препарата Котеллик®.
Таблица 1. Общие рекомендации по снижению дозы препарата Котеллик®
Степень тяжести нежелательных явлений* |
Рекомендуемая доза препарата Котеллик® |
Степень 1 или степень 2 (переносимая) |
Без снижения дозы. |
Степень 2 (непереносимая) или степень 3/4 |
|
1 проявление |
Прерывание лечения до ≤1 степени тяжести нежелательных явлений, возобновление терапии в дозе 40 мг 1 раз/сут. |
2 проявление |
Прерывание лечения до ≤1 степени тяжести нежелательных явлений, возобновление терапии в дозе 20 мг 1 раз/сут. |
3 проявление |
Рассмотреть прекращение лечения. |
* Степень тяжести нежелательных явлений в соответствии с Общими критериями токсичности нежелательных явлений Национального института рака США, версия 4.0.
Изменение дозы при развитии отдельных нежелательных реакций
Кровотечение
При возникновении кровотечений 4 степени тяжести или кровоизлияния в мозг (всех степеней) следует прервать лечение препаратом Котеллик®. Если возникновение кровотечения связано с применением препарата Котеллик®, терапия данным препаратом должна быть полностью прекращена.
При развитии кровотечений 3 степени тяжести следует прервать лечение препаратом Котеллик®. Решение о возобновлении терапии должно быть принято лечащим врачом на основании оценки клинической картины. Данные касательно эффективности модификации дозы препарата Котеллик® в случае возникновения кровотечений отсутствуют.
Лечение вемурафенибом может быть продолжено при прерывании лечения препаратом Котеллик® (при наличии клинических показаний).
Дисфункция левого желудочка
Следует рассмотреть необходимость полного прекращения лечения препаратом Котеллик®, если симптомы со стороны сердца связаны с лечением данным препаратом и в том случае, если не произошло улучшения после временного прерывания лечения.
Таблица 2. Изменение дозы препарата Котеллик® у пациентов со снижением ФВЛЖ по сравнению с исходным показателем
Пациент |
Показатель ФВЛЖ |
Рекомендуемое изменение дозы препарата Котеллик® |
Показатель ФВЛЖ после перерыва в лечении |
Рекомендуемая суточная доза препарата Котеллик® |
Без симптомов |
≥50% (или 40-49% и снижение <10% абсолютного показателя от исходного уровня) |
Продолжить лечение в текущей дозе |
— |
— |
<40% (или 40-49% и снижение ≥10% абсолютного показателя от исходного уровня) |
Прерывание лечения на 2 недели |
снижение <10% абсолютного показателя от исходного уровня |
1 появление: 40 мг 2 появление: 20 мг 3 появление: полная отмена |
|
<40% (или снижение ≥10% абсолютного показателя от исходного уровня) |
Полная отмена |
|||
С симптомами |
Не применимо |
Прерывание лечения на 4 недели |
Без симптомов и снижение <10% абсолютного показателя от исходного уровня |
1 появление: 40 мг 2 появление: 20 мг 3 появление: полная отмена |
Без симптомов и <40% (или снижение ≥10% абсолютного показателя от исходного уровня) |
Полная отмена |
|||
С симптомами, независимо от ФВЛЖ |
Полная отмена |
При изменении дозы препарата Котеллик® лечение вемурафенибом может быть продолжено (при наличии клинических показаний).
Рабдомиолиз и повышение активности креатинфосфокиназы
При возникновении рабдомиолиза или симптоматического повышения активности креатинфосфокиназы (КФК) лечение препаратом Котеллик® следует прервать. Если тяжесть уменьшилась, по меньшей мере, на одну степень в течение 4 недель, применение препарата Котеллик® следует возобновить в дозе, сниженной на 20 мг, в соответствии с клиническими показаниями. Лечение вемурафенибом может быть продолжено при изменении схемы терапии препаратом Котеллик® (при наличии клинических показаний). Лечение препаратом Котеллик® следует полностью прекратить, если тяжесть рабдомиолиза или симптоматического повышения активности КФК не снизилась в течение 4 недель.
Бессимптомное повышение активности КФК:
4 степень тяжести: лечение препаратом Котеллик® следует прервать. В случае, если активность КФК не снизилась до ≤3 степени в течение 4 недель после прерывания терапии, лечение препаратом Котеллик® следует полностью прекратить. Если тяжесть явления уменьшилась до ≤3 степени в течение 4 недель, применение препарата Котеллик® в соответствии с клиническими показаниями следует возобновить в дозе, сниженной на 20 мг, при условии тщательного наблюдения за пациентом. Лечение вемурафенибом может быть продолжено при изменении схемы терапии препаратом Котеллик®;
≤3 степени тяжести: после исключения рабдомиолиза нет необходимости изменять дозу препарата Котеллик®.
Отклонения лабораторных показателей функции печени
В случае отклонений лабораторных показателей функции печени 1 и 2 степени тяжести лечение препаратом Котеллик® и вемурафенибом следует продолжить в назначенной дозе.
3 степень тяжести: следует продолжить лечение препаратом Котеллик® в назначенной дозе. Доза вемурафениба может быть снижена в соответствии с клиническими показаниями (см. инструкцию по медицинскому применению вемурафениба).
4 степень тяжести: лечение препаратом Котеллик® и вемурафенибом следует прервать. Если отклонения лабораторных показателей функции печени уменьшились до ≤1 степени тяжести в течение 4 недель, применение препарата Котеллик® следует возобновить в дозе, сниженной на 20 мг, применение вемурафениба следует возобновить в соответствии с клиническими показаниями согласно инструкции по медицинскому применению вемурафениба.
Лечение препаратом Котеллик® и вемурафенибом следует прекратить, если отклонения лабораторных показателей функции печени не уменьшились до ≤1 степени тяжести в течение 4 недель или отклонения лабораторных показателей функции печени 4 степени тяжести возобновляются после первоначального улучшения.
Фоточувствительность
Ведение пациентов с фоточувствительностью ≤2 степени тяжести (переносимой) должно включать поддерживающую терапию.
В случае развития фоточувствительности 2 степени (непереносимой) или ≥3 степени лечение препаратом Котеллик® и вемурафенибом необходимо прервать до уменьшения тяжести симптомов до ≤1 степени. Лечение может быть возобновлено без изменения дозы препарата Котеллик®.
Дозу вемурафениба необходимо снизить согласно инструкции по применению вемурафениба (см. инструкцию по медицинскому применению вемурафениба).
Сыпь
Сыпь может возникать как на фоне лечения препаратом Котеллик®, так и вемурафенибом. При развитии сыпи лечение препаратом Котеллик® и/или вемурафенибом может быть временно прервано и/или возможно снижение дозы одного из препаратов или обоих препаратов по клиническим показаниям.
Дополнительно, при развитии сыпи:
≤2 степени (переносимой) — ведение пациентов должно включать поддерживающую терапию, лечение препаратом Котеллик® может быть продолжено без изменения дозы;
2 степени (непереносимой) или ≥3 степени:
акнеформная сыпь — необходимо следовать общим рекомендациям по изменению дозы препарата Котеллик® согласно таблице 1; лечение вемурафенибом может быть продолжено при изменении схемы терапии препаратом Котеллик® (при наличии клинических показаний);
неакнеформная или макуло-папулезная сыпь — лечение препаратом Котеллик® может быть продолжено без изменения дозы (по клиническим показаниям); лечение вемурафенибом может быть временно прервано и/или его доза снижена (см. инструкцию по медицинскому применению вемурафениба).
Окклюзия вен сетчатки
В случае возникновения окклюзии вен сетчатки терапию препаратом Котеллик® следует прекратить.
Удлинение интервала QT
Если во время лечения длительность интервала QTc превышает 500 мсек, следует обратиться к инструкции по медицинскому применению вемурафениба относительно инструкций по изменению дозы последнего. При комбинированной терапии препаратом Котеллик® и вемурафенибом изменения дозы препарата Котеллик® не требуется.
Дозирование в особых случаях
Коррекция дозы препарата Котеллик® у пациентов пожилого возраста (≥65 лет) не требуется.
Безопасность и эффективность препарата Котеллик® у детей и подростков (<18 лет) не установлены.
Согласно данным популяционного фармакокинетического анализа у пациентов с нарушением функции почек легкой или умеренной степени коррекция дозы не требуется. Безопасность и эффективность препарата Котеллик® у пациентов с тяжелым нарушением функции почек не установлены.
У пациентов с нарушением функции печени коррекция дозы не требуется. При применении препарата Котеллик® в комбинации с вемурафенибом могут отмечаться отклонения лабораторных показателей функции печени.
Побочное действие
Клинические исследования
У пациентов с поздними стадиями меланомы с BRAF V600 мутацией при применении препарата Котеллик® в комбинации с вемурафенибом медиана времени до появления первых нежелательных явлений ≥3 степени составила 0.6 месяцев.
Для описания частоты нежелательных реакций используется следующая классификация: очень часто (≥10%), часто (≥1% и <10%), нечасто (≥0.1% и <1%), редко (≥0.01% и <0.1%), очень редко (<0.01%).
Ниже представлены нежелательные реакции (всех степеней), зарегистрированные при применении препарата Котеллик® в комбинации с вемурафенибом.
Со стороны системы кроветворения: очень часто — анемия.
Со стороны органа зрения: очень часто — серозная ретинопатия (включая явления хориоретинопатии и отслойки сетчатки, как показатель серозной ретинопатии), снижение остроты зрения; часто — расстройство зрения.
Со стороны пищеварительной системы: очень часто — диарея, тошнота, рвота, стоматит.
Со стороны обмена веществ: часто — обезвоживание, гипофосфатемия, гипонатриемия, гипергликемия.
Доброкачественные, злокачественные и неуточненные новообразования (включая кисты и полипы): часто — базально-клеточный рак, кожная плоскоклеточная карцинома*, кератоакантома*.
Со стороны кожи и подкожных тканей: очень часто — фоточувствительность (включает реакции фоточувствительности, солнечные ожоги, солнечный дерматит, актинический эластоз), сыпь, макуло-папулезная сыпь, акнеформный дерматит, гиперкератоз*.
Со стороны костно-мышечной системы: рабдомиолиз**.
Со стороны сердечно-сосудистой системы: очень часто — повышение АД.
Со стороны свертывающей системы крови: часто — кровотечение***.
Со стороны дыхательной системы: часто — пневмонит.
Лабораторные и инструментальные данные: очень часто — повышение активности КФК, повышение активности АЛТ, ACT, ГГТ, ЩФ, гипокалиемия, гипоальбуминемия, гиперкалиемия, гипокальциемия, повышение концентрации креатинина, лимфопения, тромбоцитопения, повышение концентрации билирубина; часто — снижение фракции выброса.
Общие расстройства и нарушения в месте введения: очень часто — пирексия, озноб.
* См. подраздел «Кожная плоскоклеточная карцинома, кератоакантома и гиперкератоз».
** См. подраздел «Рабдомиолиз».
*** См. подраздел «Кровотечение».
Дополнительная информация по отдельным нежелательным реакциям
Кровотечение
Явления кровотечения (всех видов и степеней тяжести) чаще регистрировали при применении препарата Котеллик® в комбинации с вемурафенибом по сравнению с контрольной группой, получавшей монотерапию вемурафенибом (13% по сравнению с 7%). При применении препарата Котеллик® в комбинации с вемурафенибом наблюдалась более высокая частота внутримозговых кровоизлияний (1% по сравнению с 0%), кровотечений из ЖКТ (4% по сравнению с 1%), кровотечений из органов репродуктивной системы (2% по сравнению с <1%) и гематурии (3% по сравнению с 1%).
Большинство явлений относились к 1 или 2 степени и были несерьезными (12% по сравнению с 7%) и разрешились полностью или частично без изменения дозы препарата Котеллик®. Явления 3-4 степени развились у 1% пациентов в каждой из групп.
В зависимости от места кровотечения симптомы могут включать: головные боли, головокружение или слабость, рвоту с кровью, боль в животе, кал красной или черной окраски.
Фоточувствительность
Реакции фоточувствительности наблюдались с более высокой частотой при применении препарата Котеллик® в комбинации с вемурафенибом по сравнению с контрольной группой, получавшей монотерапию вемурафенибом (47% по сравнению с 35%). Большинство явлений были 1 или 2 степени, а явления ≥3 степени возникали у 4% пациентов при применении препарата Котеллик® в комбинации с вемурафенибом и не наблюдались в контрольной группе (0%).
Не наблюдалось каких-либо закономерностей по времени до возникновения явлений ≥3 степени. При возникновении явлений фоточувствительности ≥3 степени у пациентов, получавших препарат Котеллик® в комбинации с вемурафенибом, проводили преимущественно местную терапию в сочетании с прерыванием терапии обоими препаратами.
При проведении монотерапии кобиметинибом не наблюдалось признаков фототоксичности.
Кожная плоскоклеточная карцинома, кератоакантома и гиперкератоз
При применении препарата Котеллик® в комбинации с вемурафенибом по сравнению с контрольной группой, получавшей монотерапию вемурафенибом, реже регистрировали следующие нежелательные явления: кожную плоскоклеточную карциному (всех степеней: 3% по сравнению с 13%), кератоакантому (всех степеней: 2% по сравнению с 9%), гиперкератоз (всех степеней: 11% по сравнению с 30%).
Серозная ретинопатия
У пациентов, получавших препарат Котеллик®, отмечались случаи серозной ретинопатии. Пациентам, у которых впервые возникли или усилились нарушения зрения, рекомендовано пройти офтальмологическое обследование. Ведение пациентов с серозной ретинопатией включает прерывание лечения, снижение дозы или прекращение терапии.
Окклюзия вен сетчатки отмечалась у одного пациента в каждой из групп терапии (в группе применения препарата Котеллик® в комбинации с вемурафенибом и в контрольной группе, получавшей монотерапию вемурафенибом).
Дисфункция левого желудочка
У пациентов, получавших препарат Котеллик®, отмечалось снижение ФВЛЖ относительно исходного показателя.
ФВЛЖ необходимо оценивать перед началом лечения для определения исходных значений, затем через месяц лечения и, как минимум, каждые 3 месяца или по клиническим показаниям до прекращения лечения. Ведение пациентов со снижением ФВЛЖ относительно исходного уровня включает прерывание лечения, снижение дозы или прекращение терапии.
Рабдомиолиз
При пострегистрационном применении были зарегистрированы случаи рабдомиолиза. Признаки или симптомы рабдомиолиза служат основанием для проведения соответствующего клинического обследования и лечения по клиническим показаниям, а также для снижения дозы препарата Котеллик® или прекращения терапии в зависимости от тяжести нежелательной реакции.
Отклонения лабораторных показателей
Отклонения лабораторных показателей функции печени
У пациентов, получавших препарат Котеллик® в комбинации с вемурафенибом, отмечались отклонения лабораторных показателей функции печени, особенно, АЛТ, ACT, ЩФ. Лабораторные показатели функции печени необходимо оценивать перед началом комбинированного лечения, ежемесячно во время лечения или чаще (при наличии клинических показаний).
Повышение активности КФК
Бессимптомное повышение активности КФК крови чаще встречалось при применении препарата Котеллик® в комбинации с вемурафенибом по сравнению с контрольной группой, получавшей монотерапию вемурафенибом (всех степеней: 70% по сравнению с 14%; 3-4 степени: 12% по сравнению с <1%). Было отмечено по одному случаю рабдомиолиза с одновременным повышением активности КФК крови в каждой из групп.
Противопоказания к применению
повышенная чувствительность к кобиметинибу и к другим компонентам препарата;
тяжелые нарушения функции почек;
одновременный прием с мощными и умеренными индукторами изофермента CYP3A и мощными ингибиторами изофермента CYP3A;
беременность;
период грудного вскармливания;
детский и подростковый возраст до 18 лет (эффективность и безопасность применения не установлены).
С осторожностью
Одновременное применение умеренных ингибиторов изофермента CYP3A; недостаточности лактазы, непереносимости лактозы, глюкозо-галактозная мальабсорбция; нарушение функции печени.
Применение при беременности и кормлении грудью
Беременность
Отсутствуют данные по применению препарата Котеллик® у беременных женщин. Доклинические исследования показали, что у животных кобиметиниб приводит к гибели эмбрионов и вызывает пороки развития магистральных сосудов и черепа у плода при клинически значимых экспозициях (приблизительно в 0.9-1.4 раза превышающих клиническую экспозицию AUC в плазме крови человека).
Период грудного вскармливания
Неизвестно, выделяется ли кобиметиниб с грудным молоком. Нельзя исключить риск для новорожденных/грудных детей. Решение о рекомендации грудного вскармливания или назначении препарата Котеллик® следует принимать в зависимости от необходимости лечения препаратом для матери.
Фертильность
Влияние кобиметиниба на фертильность у человека неизвестно. Специальные доклинические исследования по изучению возможного негативного влияния препарата Котеллик® на фертильность не проводились.
В токсикологических исследованиях у животных наблюдались дегенеративные изменения в репродуктивных тканях, в т.ч. повышение уровня апоптоза/некроза желтых тел и семенных пузырьков, эпителиальных клеток придатка яичка и влагалища, а также эпителиальных клеток придатка яичка.
Контрацепция у женщин и мужчин
Необходимо использовать два эффективных метода контрацепции во время лечения препаратом Котеллик® и в течение, как минимум, 3 месяцев после прекращения лечения.
Применение при нарушениях функции печени
С осторожностью следует назначать препарат при нарушениях функции печени.
Применение при нарушениях функции почек
Противопоказано применение препарата при тяжелых нарушениях функции почек.
У пациентов с нарушением функции почек легкой или умеренной степени коррекция дозы не требуется.
Применение у детей
Противопоказано применение препарата в детском и подростковом возрасте до 18 лет.
Применение у пожилых пациентов
Коррекция дозы препарата у пациентов в возрасте ≥65 лет не требуется.
Особые указания
При применении препарата Котеллик® в комбинации с вемурафенибом необходимо также внимательно ознакомиться с инструкцией по медицинскому применению вемурафениба.
Котеллик® в комбинации с вемурафенибом у пациентов с прогрессированием заболевания при применении ингибитора BRAF
Данные по применению препарата Котеллик® в комбинации с вемурафенибом у пациентов с прогрессированием заболевания, которые ранее применяли ингибитор BRAF, ограничены. Согласно этим данным эффективность комбинации у таких пациентов будет ниже. Таким образом, следует рассмотреть альтернативные способы лечения перед применением комбинации в данной группе пациентов, которые ранее применяли ингибитор BRAF. Последовательность лечения после прогрессирования заболевания при применении ингибитора BRAF не установлена.
Препарат Котеллик® в комбинации с вемурафенибом у пациентов с метастазами в головной мозг
Оценки безопасности и эффективности лечения препаратом Котеллик® в комбинации с вемурафенибом у пациентов с метастатической меланомой (при наличии BRAF V600 мутации) с метастазами в головной мозг не проводилось. Интракраниальная активность кобиметиниба на данный момент неизвестна.
Кровотечение
При применении препарата Котеллик® могут отмечаться кровотечения, включая массивные (сопровождающиеся симптомами в критичной области или органе).
Пациент должен немедленно сообщить врачу при возникновении любого необычного кровотечения или любого из следующих симптомов: головная боль, головокружение, слабость, кровь в кале или черный кал и рвота с кровью.
Следует соблюдать осторожность при лечении пациентов с дополнительными факторами риска кровотечений, такими как метастазы в головной мозг, и/или пациентов, которые одновременно применяют лекарственные средства, повышающие риск кровотечений (включая антитромботические и антикоагулянтные средства).
Рекомендации по ведению пациентов, у которых возникли кровотечения, представлены в разделе «Режим дозирования».
Серозная ретинопатия
У пациентов, получавших ингибиторы МЕК, включая Котеллик®, наблюдались случаи серозной ретинопатии (скопление жидкости в пределах слоев сетчатки). Большинство явлений включали хориоретинопатию или отслойку сетчатки.
Медиана времени до первого появления серозной ретинопатии составляет 1 месяц (диапазон 0-9 месяцев). Большинство явлений, наблюдавшихся в клинических исследованиях, разрешились, или их тяжесть уменьшилась до бессимптомного течения 1 степени после прерывания лечения или снижения дозы.
Необходимо проводить оценку новых симптомов или усиления расстройства зрения у пациентов при каждом визите. Пациентам, у которых впервые возникли или усилились расстройства зрения, рекомендовано пройти офтальмологическое обследование. В случае диагностики серозной ретинопатии следует приостановить лечение препаратом Котеллик® до облегчения тяжести зрительных симптомов до ≤1 степени. Ведение пациентов с серозной ретинопатией включает прерывание лечения, снижение дозы или прекращение терапии.
Дисфункция левого желудочка
У пациентов, получающих Котеллик®, отмечалось снижение ФВЛЖ относительно исходного показателя. Медиана времени до первого возникновения явлений составляет 4 месяца (1-13 месяцев).
ФВЛЖ необходимо оценивать перед началом лечения для определения исходных значений, затем через месяц лечения и, как минимум, каждые 3 месяца или по клиническим показаниям до прекращения лечения. Ведение пациентов со снижением ФВЛЖ относительно исходного уровня включает прерывание лечения, снижение дозы или прекращение терапии.
У всех пациентов, которым было возобновлено лечение препаратом Котеллик® в более низкой дозе, необходимо проводить измерение ФВЛЖ по возможности через 2 недели, 4 недели, 10 недель и 16 недель, а затем по клиническим показаниям. Пациенты с исходным значением ФВЛЖ ниже нижней границы нормы учреждения или ниже 50% не изучались.
Отклонения лабораторных показателей функции печени
При применении препарата Котеллик® в комбинации с вемурафенибом, а также при монотерапии вемурафенибом (см. инструкцию по медицинскому применению вемурафениба), могут отмечаться отклонения лабораторных показателей функции печени. У пациентов, получавших препарат Котеллик® в комбинации с вемурафенибом, отмечались отклонения лабораторных показателей функции печени, особенно, АЛТ, ACT, ЩФ. Отклонения показателей функции печени необходимо оценивать по результатам лабораторных исследований перед началом комбинированного лечения, ежемесячно во время лечения или чаще (при наличии клинических показаний).
Ведение пациентов с отклонениями лабораторных показателей функции печени 3 степени тяжести включает прерывание лечения или снижение дозы вемурафениба. Ведение пациентов с отклонениями лабораторных показателей функции печени 4 степени тяжести включает прерывание лечение, снижение дозы или прекращение терапии как препаратом Котеллик®, так и вемурафенибом.
Рабдомиолиз и повышение активности КФК
У пациентов, получавших препарат Котеллик®, отмечались случаи рабдомиолиза. Если диагностирован рабдомиолиз, лечение препаратом Котеллик® следует прервать и мониторировать его симптомы и активность КФК до их разрешения. В зависимости от степени тяжести рабдомиолиза может потребоваться снижение дозы или прекращение лечения.
Повышение активности КФК 3 и 4 степени, включая бессимптомное повышение по сравнению с исходным уровнем, отмечалось у пациентов, получающих препарат Котеллик® в комбинации с вемурафенибом в клинических исследованиях. Медиана времени до первого повышения активности КФК 3 или 4 степени составила 16 дней (11 дней–10 месяцев); медиана времени до полного разрешения составила 16 дней (2 дня–15 месяцев).
Показатели креатинина и КФК сыворотки необходимо измерять перед началом лечения для определения исходных значений, затем каждый месяц во время лечения или по клиническим показаниям. Если активность КФК сыворотки повышена по сравнению с исходным уровнем, следует провести оценку наличия признаков и симптомов рабдомиолиза или других причин, вызвавших повышение данного лабораторного показателя. В зависимости от тяжести симптомов или степени повышения КФК может потребоваться перерыв в лечении, снижение дозы или прекращение терапии.
Диарея
У пациентов, получавших лечение препаратом Котеллик®, были отмечены случаи тяжелой диареи и диареи ≥3 степени тяжести. Ведение пациентов с диареей включает в себя применение противодиарейных средств и поддерживающую терапию. При диарее ≥3 степени тяжести, возникшей, несмотря на применение поддерживающей терапии, следует приостановить лечение препаратом Котеллик® и вемурафенибом до тех пор, пока не будет отмечено снижение тяжести явления до ≤1 степени. При возобновлении диареи ≥3 степени тяжести необходимо снизить дозу препарата Котеллик® и вемурафениба.
Взаимодействие с ингибиторами изофермента CYP3A
Следует избегать одновременного применения препарата Котеллик® с мощными ингибиторами изофермента CYP3A. Следует соблюдать осторожность при применении кобиметиниба одновременно с умеренными ингибиторами изофермента CYP3A. Если одновременного применения с мощным или умеренным ингибитором изофермента CYP3A нельзя избежать, следует тщательно следить за безопасностью пациентов, а также при необходимости снижать дозу согласно рекомендациям, представленным в таблице 1.
Удлинение интервала QT
Если во время лечения длительность интервала QTc превышает 500 мсек, следует обратиться к инструкции по медицинскому применению вемурафениба.
Другие препараты и препарат Котеллик®
Пациент должен сообщить лечащему врачу о приеме каких-либо других препаратов перед началом применения препарата Котеллик®, поскольку он может влиять на действие некоторых препаратов.
Вспомогательные вещества
Препарат Котеллик® содержит лактозу. Пациентам с редкой наследственной непереносимостью галактозы, врожденной недостаточностью лактазы или глюкозо-галактозной мальабсорбцией следует проконсультироваться с лечащим врачом для индивидуального обсуждения случаев, когда польза превосходит риск.
Препарат Котеллик® содержит менее 1 ммоль натрия (23 мг) в 1 таблетке, т.е. можно считать, что практически не содержит натрий.
Уничтожение неиспользованного препарата или препарата с истекшим сроком годности следует проводить в соответствии с локальными требованиями.
Влияние на способность к управлению транспортными средствами и механизмами
Исследования влияния препарата Котеллик® на способность к вождению транспортных средств и работу с машинами и механизмами не проводились. Во время проведения клинических исследований у пациентов, получавших препарат Котеллик®, были зарегистрированы расстройства зрения. Пациентам в случае нарушений со стороны органа зрения не следует управлять транспортными средствами и работать с машинами и механизмами без консультации с врачом.
Передозировка
В клинических исследованиях не наблюдалось случаев передозировки.
Лечение: в случае предполагаемой передозировки лечение препаратом Котеллик® следует приостановить и начать проведение поддерживающей терапии. Специфического антидота, который можно было бы использовать в случаях передозировки препарата Котеллик®, не существует.
Лекарственное взаимодействие
Влияние сопутствующих лекарственных препаратов на кобиметиниб
Ингибиторы изофермента CYP3A
Кобиметиниб метаболизируется с участием изофермента CYP3A. У здоровых лиц в присутствии мощного ингибитора изофермента CYP3A (итраконазола) AUC кобиметиниба увеличивается приблизительно в 7 раз. Существует вероятность, что магнитуда взаимодействия у пациентов будет ниже.
Мощные ингибиторы изофермента CYP3A
При лечении кобиметинибом следует избегать одновременного применения мощных ингибиторов изофермента CYP3A, в т.ч. ритонавира, кобицистата, телапревира, лопинавира, итраконазола, вориконазола, кларитромицина, телитромицина, позаконазола, нефазодона и грейпфрутового сока. Если одновременного применения с мощным ингибитором изофермента CYP3A нельзя избежать, следует тщательно следить за безопасностью пациентов. В случае кратковременного (≤7 дней) применения мощных ингибиторов изофермента CYP3A следует рассмотреть возможность приостановки лечения кобиметинибом во время применения такого ингибитора.
Умеренные ингибиторы изофермента CYP3A
Следует соблюдать осторожность при применении кобиметиниба одновременно с умеренными ингибиторами изофермента CYP3A, в т.ч. амиодароном, эритромицином, флуконазолом, миконазолом, дилтиаземом, верапамилом, делавирдином, ампренавиром, фосампренавиром, иматинибом. При одновременном применении кобиметиниба с умеренным ингибитором изофермента CYP3A следует тщательно следить за безопасностью пациентов.
Слабые ингибиторы изофермента CYP3A
Кобиметиниб можно применять одновременно со слабыми ингибиторами изофермента CYP3A без коррекции дозы.
Индукторы изофермента CYP3A
Одновременное применение кобиметиниба с мощным индуктором изофермента CYP3A не оценивалось в ходе клинического исследования, однако вероятно снижение экспозиции кобиметиниба. Таким образом, одновременного применения умеренных и мощных индукторов изофермента CYP3A (например, карбамазепин, рифампицин, фенитоин и зверобой продырявленный) следует избегать. Необходимо рассмотреть возможность применения препаратов с отсутствующей или минимальной индукцией изофермента CYP3A в качестве альтернативы. Эффективность может быть снижена, поскольку существует вероятность значительного уменьшения концентрации кобиметиниба при одновременном применении с умеренными и мощными индукторами изофермента CYP3A.
Ингибиторы Р-гликопротеина
Кобиметиниб является субстратом Р-гликопротеина. При одновременном применении с ингибиторами Р-гликопротеина, такими как циклоспорин и верапамил, существует вероятность повышения концентрации кобиметиниба в плазме крови.
Влияние кобиметиниба на сопутствующие лекарственные препараты
Субстраты изоферментов CYP3A и CYP2D6
Клиническое исследование лекарственного взаимодействия у пациентов с онкологическим заболеванием показало, что в присутствии кобиметиниба концентрации мидазолама (чувствительного субстрата CYP3A) и декстрометорфана (чувствительного субстрата CYP2D6) в плазме крови не менялись.
Субстраты изофермента CYP1A2
Кобиметиниб является потенциальным индуктором изофермента CYP1A2 in vitro, таким образом, вероятно снижение экспозиции субстратов данного фермента, например, теофиллина. Клинических исследований лекарственного взаимодействия для оценки клинической значимости данного явления не проводилось.
Субстраты BCRP (breast cancer resistance protein — белок устойчивости рака молочной железы)
Кобиметиниб является умеренным ингибитором BCRP in vitro. Клинических исследований лекарственного взаимодействия для оценки данного явления не проводилось. Клиническая значимость ингибирования интестинального BCRP не может быть исключена.
Другие противоопухолевые препараты
Вемурафениб
У пациентов с неоперабельной или метастатической меланомой не отмечено клинически значимого лекарственного взаимодействия между препаратом Котеллик® и вемурафенибом, таким образом, коррекция дозы не рекомендуется.
Влияние кобиметиниба на транспортные системы лекарственных препаратов
В исследованиях in vitro показано, что кобиметиниб не является субстратом транспортных белков ОАТР1В1, ОАТР1В3 и ОСТ1, являясь слабым ингибитором этих транспортных белков. Клиническая значимость этих данных не установлена.
Условия хранения
Препарат следует хранить в недоступном для детей месте при температуре не выше 30°С.
Срок годности препарата
Срок годности — 5 лет. Не использовать по истечении срока годности.
Условия реализации
Препарат отпускается по рецепту.

Противоглистные средства – химиотерапевтические препараты, предназначенные для лечения болезней, вызванных паразитическими червями и/или их личинками. Возбудители глистных инвазий могут поражать различные органы и системы человеческого организма. В зависимости от области локализации возбудителя болезни назначается лечение. Самостоятельно определить источник неприятной симптоматики непросто, а уж тем более подобрать правильное лекарство. Лучший глистогонный препарат может назначить только врач после проведения комплексной диагностики и получения результатов анализов.
Паразитарные заболевания достаточно распространены. Например, протозойные инфекции могут поражать как взрослых, так и детей. Среди людей встречается около 30% носителей токсоплазмы, которые не имеют симптомов заболевания. Кишечную амебу диагностируют у 40-50% населения. Если лечение отсутствует, то смертность от дизентерии, спровоцированной данным паразитом, составляет 40%. Лямблиозом заражено около 12% россиян, среди которых 50-80% — это дети.
Причины и особенности развития глистных инвазий
Широкая распространенность обусловлена высоким уровнем контагиозности инфекций. Среди основных причин развития глистных инвазий следует выделить:
- пренебрежение стандартными правилами личной гигиены;
- недостаточное мытье овощей и фруктов;
- неосторожный контакт с животными;
- беспорядочные и незащищенные половые связи.
Причиной повышения числа заболевших людей является приобретение возбудителем резистентности к современным лекарственным средствам. Многие противоглистные средства имеют достаточно высокую степень токсичности, поэтому вызывают серьезные осложнения, особенно в случае с детьми.
Энтеробиоз

Острицы являются одним из наиболее распространенных возбудителем глистных инвазий. Около 50% людей заражаются острицами один раз в жизни. Паразиты, принадлежащие к роду круглых и нитевидных червей, откладывают яйца в складках заднего прохода, что приводит к раздражающему зуду.
Типичные симптомы заражения маленькими белыми червями (при которых самки могут вырасти до 13 мм, самцы до 5 мм), включают:
- сильный зуд, особенно вечером и ночью;
- потеря аппетита;
- наличие паразитов в фекалиях (можно заметить невооруженным глазом);
- потеря веса, диарея, боль в животе;
- кишечное кровотечение (в тяжелых случаях).
Самки остриц откладывают до 10 000 яиц в складках заднего прохода ночью, вызывая сильный зуд. При расчесывании яйца могут снова попасть внутрь через рот и вызвать еще одну цепочку инфекции.
Аскаридоз
Опаснее остриц являются круглые черви (нематоды), которые вызывают желудочно-кишечные проблемы. Они розово-белые, от 25 до 45 см в длину и поселяются в тонком кишечнике. Заражение происходит фекально-оральным путем или через овощи, удобренные фекалиями.
|
Личинки паразитов часто вызывают аллергические реакции и поражают внутренние органы. Полномасштабные круглые черви могут блокировать протоки поджелудочной железы, а также желчные протоки и вызывать колики из-за их размера.
При незначительном заражении круглыми червями дискомфорта почти не возникает. При сильном заражении могут возникать следующие симптомы:
|
Если личинки проникают через кровь в легкие, могут возникать кашель и астматические судороги. В тяжелых случаях паразиты могут вызвать непроходимость или паралич кишечника.
«Паразитарный рак» (альвеококкоз, тениаринхоз)
Широко распространенным видом червей в кишечнике являются также ленточные черви, принадлежащие к семейству плоских. Они, как следует из названия, плоские и имеют длину от 3 мм до 20 м в зависимости от вида.
Особенно опасен эхинококкоз. Возбудители обычно передаются человеку через контакт с инфицированными животными, такими как собаки или кошки. Поэтому важна регулярная дегельминтизация домашних животных. После поглощения яиц лисьего ленточного червя в различных органах образуются кисты. Особенно часто поражаются печень, легкие и мозг. Кисты могут даже достигать размера шара. Поскольку между инфекцией и вспышкой симптомов болезни может пройти около 10 лет, диагностика и терапия существенно осложняются.
Заражение ленточными червями проявляется в следующих симптомах:
- кусочки белых ленточных червей в каловых массах;
- боль в животе;
- головные боли;
- судороги;
- диарея;
- отек (из-за кист);
- потеря веса.
Также присутствует кашель и проблемы с дыханием при поражении легких или бронхов. В тяжелых случаях возможно поражение головного мозга и печени.
Как выбрать таблетки от глистов для человека

Для начала нужно пройти обследование, чтобы выявить тип паразита, который является возбудителем заболевания. Действие лекарственных средств направлено на подавление активности глистов и выведение их из организма естественным путем.
При выборе лекарственного средства нужно учесть не только спектр действия, но и следующие критерии:
- Состав. На основе растительных или синтетических компонентов разработан препарат. Последние являются более эффективными. Также следует обратить внимание на концентрацию действующего вещества.
- Фармакология. Необходимо учесть силу «медикаментозного удара» на организм. Перед покупкой рекомендуется уточнить противопоказания и ознакомиться с возможными последствиями для здоровья.
- Время достижения результата. Чем быстрее препарат действует, тем тяжелее будет восстановительный период. Препараты, обладающие «мягким» воздействием, требуют длительного курса применения.
Хорошие глистогонные таблетки воздействуют не только на взрослых особей, но и на личиночные формы, выводя обездвиженных или погибших особей из организма. При выборе следует учитывать особенности приема и стоимость лекарственного средства.
Классификация глистогонных препаратов
Раньше с глистами боролись преимущественно средствами растительного происхождения: хеноподиевое масло, цитварную полынь и пр. В последнее время фармацевтические компании предоставили большой выбор препаратов.
Разработанных на основе синтетических веществ, которые обладают выраженной противоглистной активностью и являются более безопасными.
Противоглистные препараты разделены на группы в зависимости от оказываемого действия на классы гельминтов (противотрематодозные, противоцестодозные и противонематодозные). Некоторые средства обладают комплексным воздействием.
По механизму действия выделяют лекарства, которые воздействуют на:
- нервную систему гельминтов (наркотические; оказывают влияние на передачу нервных импульсов);
- кутикулу паразитов (вызывают ожоги);
- нервно-мышечную систему;
- ферментативные процессы (угнетают или усиливают аэробное дыхание).
При тяжелых формах поражения глаз, мозга и мышц возникает необходимость в проведении хирургического вмешательства.
Рейтинг препаратов от глистов
Мы предлагаем рейтинг лучших глистогонных препаратов, основанный на их эффективности, безопасности и соотношении цена-качество. При составлении ТОПа были учтены отзывы пациентов, которые прошли лечение, а также статистические данные медицинских учреждений.
Следует иметь в виду, что при проведении противоглистного лечения в большинстве случаев необходимо исследовать ОАК (общий анализ крови) и проводить функциональные печеночные тесты.
№1 – «Декарис»
Лучшее глистогонное средство для людей, разработанное на основе левамизола. Это вещество пагубно влияет на нервно-мышечную систему круглого червя. Кроме того, препарат стимулирует иммунитет человека, что позволяет мобилизовать защитные силы организма против паразитов.
№2 – «Немозол»
Самое лучшее глистогонное средство, которое часто используется при лямблиозе. Этот антипаразитарный препарат относится к группе бензимидазола. Широко используется при заражении нематодами, цестодами и трематодами. Выпускается в форме суспензии и таблеток.
№3 – «Пирантел» (Медана Фарма, Польша)
Суспензия вызывает нервно-мышечную блокаду у гельминтов. Назначается преимущественно пациентам детского возраста. Благодаря своему действию оказывает влияние на все возрастные группы паразитов, т. е. как на незрелых, так и на половозрелых особей. Но препарат не влияет на личинки, особенно те, которые находятся в фазе миграции.
№4 – «Пирантел» (Польфарма, Польша)
Препарат после употребления почти не всасывается из пищеварительного тракта. Максимальная концентрация в крови после разовой дозы достигается через 1-3 часа. Метаболизируется в печени и выводится из организма почти в неизмененном виде, в основном через кишечник (93%). Еще 7% может выводиться почками в виде метаболитов или просто в неизмененном виде.
Указания по применению таблеток «Пирантел»:
- аскаридоз;
- трихоцефалез;
- некатороз;
- анкилостомидоз.
Дозировка препарата должна быть установлена врачом, исходя из данных о возрасте пациента, весе, а также противопоказаний и возможности побочных эффектов.
№5 – «Пирантел» (Oxford Laboratories, Индия)
Лучшее глистогонное средство для человека широкого спектра действия, которое эффективно справляется с анкилостомидозом, энтеробиозом, некаторозом и аскаридозом. При энтеробиозе следует лечить одновременно всех лиц, проживающих в одной квартире. Эта мера направлена на то, чтобы исключить возможность повторного заражения, например, одним из членов семьи. После лечения необходимо сдать анализы, чтобы проверить наличие паразитов в организме больного.
Выпускается в форме суспензии и таблеток. Рекомендуется принимать до или во время еды. С осторожностью назначается детям до 6-ти месячного возраста и при миастении.
№6 – «Тройчатка» (Эвалар, Россия)
Лучший глистогонный препарат для людей, разработанный на растительной основе. Активные компоненты создают в организме человека неблагоприятные условия для паразитов. Травяные горечи способствуют сокогонному и желчегонному действию. Это способствует выведению паразитов наружу вместе с продуктами их жизнедеятельности.
№7 – «Немозол» (Ипка Лабораториз, Индия)
Противогельминтный препарат, который обладает ингибирующим эффектом, ведущим к нарушению процессов жизнедеятельности гельминтов. «Немозол» наиболее эффективен против цестод и нематод.
Основные противопоказания: повышенная чувствительность к альбендазолу, цирроз печени и печеночная недостаточность, лейкопения, патологии сетчатки глаза, дети до 2-х лет.
№8 – «Декарис» (Гедеон Рихтер, Россия)
Для взрослых выпускается в виде белых таблеток. Они содержат 150 мг активного вещества. В их составе нет красителей и ароматизаторов. Для детей готовят в виде апельсиновых таблеток. Они содержат 50 мг действующего компонента.
Содержит левамизол, парализующий мышцы гельминтов. В течение 24 часов после употребления иммобилизованные паразиты вместе с дефекацией покидают кишечник. Поскольку препарат не убивает, а только парализует червей, он действует на организм человека более мягко, чем другие глистогонные средства.
№9 – «Вормин» (Cadila, Индия)
Разработан на основе мебендазола. Обладает ярко выраженным глистогонным действием. Эффективен против возбудителей энтеробиоза.
Когда таблетка попадает в область желудочно-кишечного тракта, активные компоненты препарата быстро всасываются. Действующее вещество вызывает необратимые процессы в организме гельминтов и предотвращает их дальнейшее движение и размножение.
№10 – «Пиперазин» (Фармстандарт-Лексредства, Россия)
Завершает рейтинг глистогонных препаратов для людей. Назначается при энтеробиозе и аскаридозе. Пиперазина адипат способствует усилению выраженности нарушений в организме гельминтов. Не рекомендуется использовать при нарушениях со стороны ЦНС, при беременности, лактации и в случае хронической почечной недостаточности.
Выводы
Если появились подозрения на наличие глистов, то не стоит медлить с визитом к врачу. Специалист назначит диагностику и подберет оптимальное лечение. Только на основании полученных результатов можно сделать заключение, какой глистогонный препарат лучше для каждого конкретного случая.
Не стоит пытаться вылечить гельминтозы народными средствами. Ни одно лекарственное растение не оказывает комплексного эффекта. Даже если паразиты будут обездвижены, они останутся в организме и вызовут интоксикацию. Лучшее средство от глистов это профилактика с помощью щадящих лекарственных препаратов, которые следует принимать 1-2 раза в год.
Литература:
https://www.rlsnet.ru/fg_index_id_249.htm
https://medum.ru/protivoglistnye-preparaty
https://бмэ.орг/index.php/ПРОТИВОГЛИСТНЫЕ_СРЕДСТВА
https://www.eurolab.ua/parenting/2505/2518/49537/

ИМЕЮТСЯ ПРОТИВОПОКАЗАНИЯ. ВОЗМОЖНЫ ПОБОЧНЫЕ ЭФФЕКТЫ. НЕОБХОДИМА КОНСУЛЬТАЦИЯ СПЕЦИАЛИСТА.
Содержание
- Пирантел: от чего
- Пирантел: когда начинает действовать
- Пирантел: механизм действия
- Пирантел: дозировка
- Пирантел суспензия: дозировка
- Пирантел: как принимать
- Пирантел и алкоголь: совместимость
- Декарис или Пирантел: что лучше
- Задайте вопрос эксперту по теме статьи
Во всем мире гельминтами заражено около 1,5 млрд человек, или 24% мирового населения. У детей гельминтозы приводят к нарушениям всасывания питательных веществ и физического развития. Для борьбы с гельминтозами существует ряд безопасных и эффективных лекарственных средств.
Расскажем о препарате Пирантел: от чего его назначают, как быстро действует, о механизме действия, формах выпуска и дозировках, как правильно его принимать, а также совместим ли с алкоголем и сравним с аналогом Декарис.
Пирантел: от чего
Если говорить коротко, то Пирантел от глистов. А точнее он применяется при:
- Аскаридозе;
- Энтеробиозе;
- Анкилостомидозе;
- Некаторозе;
- Трихоцефалезе.
Пирантел: когда начинает действовать
Лекарство Пирантел действует в течение суток. Необходимо время, чтобы препарат прошел весь ЖКТ и подействовал.
Пирантел: механизм действия
Пирантел действует на паразитов в ранней фазе развития и на их зрелые формы. Но не действует на личинки. Он блокирует двигательную активность у чувствительных к нему паразитов, что значительно облегчает их выведение из пищеварительного тракта.
Пирантел: дозировка
В одной таблетке действующее вещество содержится в дозировке 250 мг.
Пирантел суспензия: дозировка
В 5 мл суспензии Пирантела содержится 250 мг действующего вещества.
Пирантел: как принимать
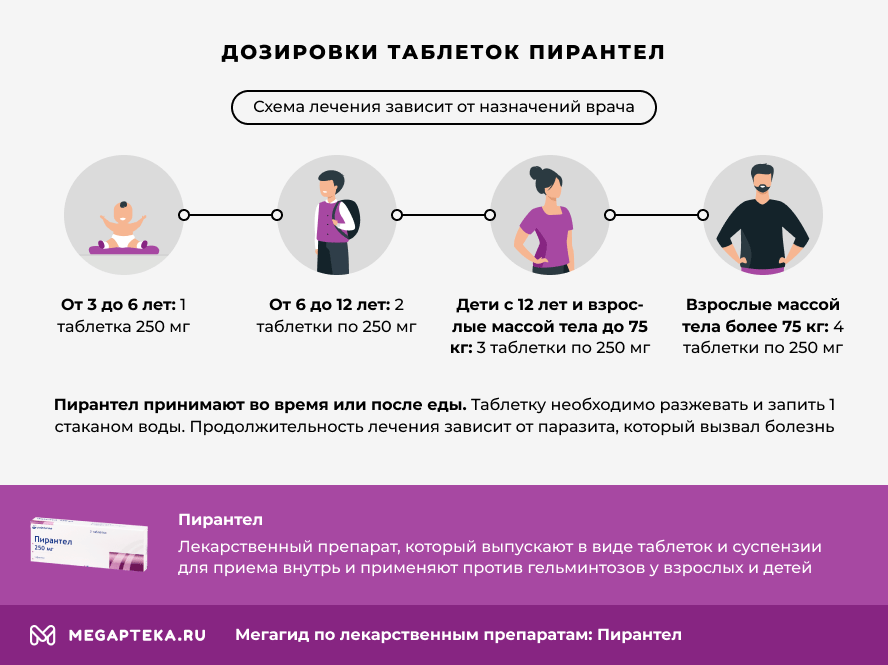
Пирантел принимают во время или после еды. Таблетку необходимо разжевать и запить 1 стаканом воды.
Схема лечения зависит от назначений врача. Обычно используют следующую схему:
- от 3 до 6 лет разово принимают 1 таблетку 250 мг.
- от 6 до 12 лет принимают 2 таблетки по 250 мг;
- дети старше 12 лет и взрослые массой тела до 75 кг — 3 таблетки по 250 мг;
- взрослые массой тела более 75 кг — 4 таблетки по 250 мг.
Продолжительность лечения зависит от паразита, который вызвал болезнь.
Пирантел и алкоголь: совместимость
О совместном применении Пирантел и алкоголя производитель не указал информации в инструкции. Потому рекомендуем придерживаться общих правил и не употреблять алкоголь во время лечения.
Пирантел имеет следующие побочные действия:
- со стороны ЖКТ — тошнота, рвота, боль в животе, диарея, потеря аппетита, повышение показателей печени в крови (АСТ, АЛТ);
- со стороны нервной системы — головная боль, головокружение, слабость, сонливость, бессонница, галлюцинации;
- аллергические реакции — зуд, крапивница, кожная сыпь;
- нарушение слуха;
- повышенная температура тела.
Декарис или Пирантел: что лучше
Оба средства являются противогельминтными, то есть их действие направлено на уничтожение паразитов в кишечнике. Разница лекарств заключается в действующих веществах: у Декарис это левамизол, а у Пирантел — одноименное вещество пирантел.
И то и другое лекарство может быть назначено к применению взрослым и детям с 3-летнего возраста. А также беременным и кормящим, но только в том случае, когда предполагаемая польза для матери превышает потенциальный риск для плода.
Еще одна разница лекарств — в их производителе. Декарис производится в Венгрии в форме таблеток дозировкой 50 мг и 150 мг. Пирантел — препарат отечественного производства, выпускается в форме таблеток (250 мг) и в виде суспензии с дозировкой 250 мг на 5 мл.
По удобству применения Декарис превосходит Пирантел, так как его применяют однократно, а Пирантел следует принимать 2-3 дня.
Что лучше Пирантел или Декарис, решает врач. У Пирантела больше показаний к применению, чем у Декариса. Для эффективного лечения нужно установить диагноз. Это может сделать только врач.
В заключении напомним, что Пирантел — это противогельминтное средство, и назначается оно от глистов. Пирантел действует спустя несколько часов. В связи с этим Пирантел принимают в течение 2-3 дней.
Пирантел действует на гельминтов, парализуя их мышечную и нервную систему, чем обездвиживает их и облегчает выведение.
В таблетках и в суспензии действующее вещество содержится в дозировке 250 мг, из расчета на 1 таблетку или на 5 мл суспензии. Во время лечения мы не рекомендуем принимать алкоголь, чтобы не вызвать побочные эффекты.
Пирантел и Декарис имеют разные действующие вещества и показания. Поэтому, что из них лучше для каждого пациента, решает врач.
Задайте вопрос эксперту по теме статьи
Остались вопросы? Задайте их в комментариях ниже – наши эксперты ответят вам. Там же Вы можете поделиться своим опытом с другими читателями Мегасоветов.
от 187,90 ₽
Выпускающий редактор
Эксперт-провизор
Котеллик — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер
ЛП-003464 — 070817
Торговое наименование
Котеллик
Международное непатентованное название
Кобиметиниб
Лекарственная форма
Таблетки, покрытые пленочной оболочкой
Состав
1 таблетка, покрытая пленочной оболочкой, содержит:
действующее вещество: кобиметиниб – 20.00 мг (в виде кобиметиниба гемифумарата – 22.20 мг);
вспомогательные вещества: целлюлоза микрокристаллическая – 54.72 мг; лактозы моногидрат – 36.48 мг, кроскармеллоза натрия – 4.80 мг, магния стеарат – 1.80 мг; пленочная оболочка 1: поливиниловый спирт – 1.92 мг, титана диоксид (Е171) – 1.20 мг, макрогол 2 – 0.97 мг, тальк – 0.71 мг.
1 Допускается использование коммерчески доступной смеси для нанесения пленочной оболочки идентичного состава (например, Opadry II White 85F18422).
2 Синоним – полиэтиленгликоль, PEG 3350.
Описание
Круглые двояковыпуклые таблетки, покрытые пленочной оболочкой, белого цвета; на одной стороне таблетки гравировка «COB».
Фармакотерапевтическая группа
Противоопухолевое средство – протеинкиназы ингибитор.
Код АТХ [L01XE38]
Фармакологические свойства
Фармакодинамика
Механизм действия
Путь митоген-активируемой протеинкиназы MAPK (Mitogen-Activated Protein Kinase) / внеклеточной сигнал-регулируемой киназы ERK (Extracellular signal Regulated Kinase) является основным путем передачи сигнала, который регулирует пролиферацию клеток, клеточный цикл, выживаемость клеток, ангиогенез и миграцию клеток.
Препарат Котеллик – пероральный высокоселективный аллостерический ингибитор киназ MEK1/2 (MAPK/ERK Kinase). В биохимических и цитологических исследованиях кобиметиниб продемонстрировал высокую ингибирующую способность, а также активность в отношении широкого спектра опухолей in vivo на моделях ксенотрансплантата опухолей, включая опухоли, несущие мутации BRAF и KRAS.
В биохимических и структурных исследованиях было показано взаимодействие кобиметиниба с MEK, с незначительной чувствительностью к динамическим конформационным изменениям, наблюдаемым при переходе MEK в фосфорилированную форму. Как результат, кобиметиниб сохраняет связывающую способность и ингибирующую активность при фосфорилировании MEK. Кобиметиниб показал наиболее высокую активность в отношении линий опухолевых клеток и опухолей с высокими уровнями фосфорилирования MEK, что часто наблюдается в опухолях с мутациями BRAF.
В доклинических исследованиях обработка кобиметинибом MAPK-дисрегулированных опухолевых клеток и опухолей приводит к фосфорилированию киназ ERK1/2, единственных известных субстратов MEK1/2.
Передача сигнала по MAPK-пути зависит от активности киназ ERK1/2, которые фосфорилируют белковые мишени в цитоплазме и ядре, в свою очередь индуцирующие прогрессирование клеточного цикла, пролиферацию клеток, выживаемость и миграцию клеток. Таким образом, кобиметиниб противодействует промитогенной и онкогенной активности, индуцируемой через MAPK-путь, за счет ингибирования MEK1/2. Комбинация вемурафениба и препарата Котеллик ингибирует реактивацию MAPK-пути через MEK1/2 за счет одновременного воздействия на BRAF и MEK, приводя к более выраженному подавлению передачи сигналов, апоптозу большего числа опухолевых клеток и усилению опухолевых ответов в доклинических моделях по сравнению с монотерапией вемурафенибом.
Доклинические данные по безопасности
Канцерогенность
Исследования канцерогенности кобиметиниба не проводились.
Мутагенность
Стандартные исследования генотоксичности дали отрицательные результаты.
Прочее
Удлинение интервала QT
В условиях in vitro кобиметиниб вызывает умеренно выраженное ингибирование ионного hERG-канала (концентрация, необходимая для ингибирования hERG-канала (IC50) = 0.5 мкМ [266 нг/мл]), что приблизительно в 18 раз больше, чем максимальная концентрация в плазме крови (Сmax) при применении в дозе 60 мг (Сmax несвязанного препарата = 14 нг/мл [0.03 мкM]).
При лечении пациентов препаратом Котеллик в комбинации с вемурафенибом не отмечалось дополнительного клинического влияния на удлинение интервала QT.
Оценка общей токсичности
В исследованиях токсичности у крыс и собак были выявлены в целом обратимые дегенеративные изменения в костном мозге, желудочно-кишечном тракте, коже, тимусе, надпочечниках, печени, селезенке, лимфатических узлах, почках, сердце, яичниках и влагалище при экспозиции в плазме ниже клинически эффективного уровня.
Доклинические исследования не выявили специфических рисков для человека (на основании результатов стандартных фармакологических исследований по безопасности и генотоксичности).
Фармакокинетика
Всасывание
При приеме кобиметиниба в дозе 60 мг у пациентов с онкологическими заболеваниями отмечается умеренная скорость всасывания с медианой времени до достижения максимальной концентрации в плазме крови (Tmax) 2.4 часа. Средние показатели Cmax в равновесном состоянии и площади под кривой «концентрация-время» (AUC0-24) составляют 273 нг/мл и 4340 нг*ч/мл, соответственно. Среднее значение коэффициента накопления в равновесном состоянии составляет приблизительно 2.4.
Кобиметиниб обладает линейной фармакокинетикой в диапазоне доз от приблизительно 3.5 мг до 100 мг.
Абсолютная биодоступность кобиметиниба у здоровых лиц составляет 45.9%. У здоровых лиц было показано, что кобиметиниб интенсивно метаболизируется и выводится через кишечник. Степень всасывания составляет приблизительно 88%, что указывает на высокий уровень всасывания и пресистемный метаболизм.
Фармакокинетика кобиметиниба не изменяется при приеме препарата с пищей (в том числе и с высоким содержанием жиров) по сравнению с приемом натощак у здоровых лиц. Поскольку пища не влияет на фармакокинетику кобиметиниба, препарат можно принимать независимо от приема пищи.
Распределение
Связывание кобиметиниба с белками плазмы in vitro составляет 94.8%. При этом не наблюдается преимущественного связывания с эритроцитами человека (соотношение кровь-плазма 0.93).
Объем распределения у здоровых лиц, получивших дозу 2 мг внутривенно (в/в), составляет 1050 л. По данным популяционного фармакокинетического анализа кажущийся объем распределения у онкологических больных составляет 806 л.
Метаболизм
Соотношение кобиметиниба и его метаболитов было изучено в ходе исследования массового баланса у здоровых лиц.
В среднем, 94% дозы восстанавливается в течение 17 дней. Кобиметиниб интенсивно метаболизируется и выводится через кишечник; при этом не отмечается преобладания ни одного из метаболитов.
Основные пути метаболизма кобиметиниба – окисление с помощью изофермента CYP3A и глюкуронирование с помощью изофермента UGT2B7. Кобиметиниб является основным веществом, выявляемым в плазме крови. Доля окисленных метаболитов в плазме крови составляет не более 10% от общего числа циркулирующей радиоактивности, при этом специфических для человека метаболитов не выявлено.
Доля неизмененного препарата в кале и моче составляет 6.6% и 1.6% от введенной дозы, соответственно, что указывает на то, что кобиметиниб преимущественно подвергается метаболизму и в незначительном количестве выводится почками. Данные in vitro показывают, что кобиметиниб не является ингибитором OAT1, OAT3 или OCT2.
Выведение
После в/в введения кобиметиниба в дозе 2 мг средний клиренс составляет 10.7 л/ч. Средний кажущийся клиренс у онкологических больных после перорального приема кобиметиниба в дозе 60 мг составляет 13.8 л/ч.
Средний период полувыведения кобиметиниба составляет 43.6 часов (диапазон от 23.1 до 69.6 часов).
Фармакокинетика у особых групп пациентов
По данным популяционного фармакокинетического анализа пол, раса, этническая принадлежность, исходная оценка по ECOG, а также легкое и умеренное нарушение функции почек не влияют на фармакокинетику кобиметиниба.
Статистически значимыми ковариантами для клиренса и объема распределения кобиметиниба являются возраст и масса тела, соответственно. Однако согласно результатам анализа чувствительности ни одна из этих ковариант не оказывает клинически значимого влияния на экспозицию в равновесном состоянии.
Пол
По данным популяционного фармакокинетического анализа пол не оказывает влияния на экспозицию кобиметиниба.
Лица пожилого возраста
По данным популяционного фармакокинетического анализа возраст не оказывает влияния на экспозицию кобиметиниба.
Пациенты с нарушением функции почек
По данным доклинических исследований и исследований массового баланса, кобиметиниб преимущественно подвергается метаболизму с минимальным выведением почками.
Специальные исследования фармакокинетики кобиметиниба у пациентов с нарушением функции почек не проводились.
Согласно результатам популяционного фармакокинетического анализа данных у пациентов с легким и умеренным нарушением функции почек, а также у пациентов с нормальной функцией почек (клиренс креатинина (КК) ≥90 мл/мин) КК не оказывает значимого влияния на экспозицию кобиметиниба.
По данным популяционного фармакокинетического анализа нарушение функции почек легкой и средней степени тяжести не влияет на экспозицию кобиметиниба.
Недостаточно данных для определения необходимости в коррекции дозы у пациентов с тяжелым нарушением функции почек.
Пациенты с нарушением функции печени
Фармакокинетику кобиметиниба оценивали у пациентов с легким нарушением функции печени (класс A по Чайлд-Пью), у пациентов с умеренным нарушением функции печени (класс B по Чайлд-Пью), у пациентов с тяжелым нарушением функции печени (класс C по Чайлд-Пью) и у здоровых лиц. У пациентов с легким или умеренным нарушением функции печени по сравнению со здоровыми лицами системная экспозиция после применения однократной дозы кобиметиниба была сходной. У пациентов с тяжелым нарушением функции печени отмечались более низкие экспозиции кобиметиниба (среднее геометрическое соотношение AUC0-∞ составляет 0.69 по сравнению со здоровыми лицами).
Данное явление не считается клинически значимым. Таким образом, пациентам с нарушением функции печени при применении препарата Котеллик коррекция дозы не рекомендуется.
Показания к применению
Неоперабельная или метастатическая меланома с BRAF V600 мутацией у взрослых пациентов в комбинации с вемурафенибом.
Противопоказания
- Повышенная чувствительность к кобиметинибу и к другим компонентам препарата.
- Беременность и период грудного вскармливания.
- Детский возраст до 18 лет (эффективность и безопасность применения не установлены).
- Одновременный прием с мощными и умеренными индукторами изофермента CYP3A и мощными ингибиторами изофермента CYP3A.
- Тяжелые нарушения функции почек.
С осторожностью
Одновременный прием с умеренными ингибиторами изофермента CYP3A. Недостаточность лактазы, непереносимость лактозы, глюкозо-галактозная мальабсорбция.
Применение при беременности и в период грудного вскармливания
Беременность
Отсутствуют данные по применению препарата Котеллик у беременных женщин. Доклинические исследования показали, что у животных кобиметиниб приводит к гибели эмбрионов и вызывает пороки развития магистральных сосудов и черепа у плода при клинически значимых экспозициях (приблизительно в 0.9-1.4 раза превышающих клиническую экспозицию AUC в плазме крови человека).
Контрацепция у женщин и мужчин
Необходимо использовать два эффективных метода контрацепции во время лечения препаратом Котеллик и в течение, как минимум, трех месяцев после прекращения лечения.
Период грудного вскармливания
Неизвестно, выделяется ли кобиметиниб с грудным молоком. Нельзя исключить риск для новорожденных/грудных детей. Решение о рекомендации грудного вскармливания или назначении препарата Котеллик должно приниматься в зависимости от необходимости лечения препаратом для матери.
Фертильность
Влияние кобиметиниба на фертильность у человека неизвестно.
Специальные доклинические исследования по изучению возможного негативного влияния препарата Котеллик на фертильность не проводились.
В токсикологических исследованиях у животных наблюдались дегенеративные изменения в репродуктивных тканях, в том числе повышение уровня апоптоза/некроза желтых тел и семенных пузырьков, эпителиальных клеток придатка яичка и влагалища, а также эпителиальных клеток придатка яичка.
Способ применения и дозы
Лечение препаратом Котеллик должен начинать и контролировать врач, имеющий опыт лечения пациентов с онкологическими заболеваниями.
Перед применением препарата Котеллик в комбинации с вемурафенибом должен быть проведен валидированный тест на наличие BRAF V600 мутации.
При применении препарата Котеллик в комбинации с вемурафенибом см. также инструкцию по медицинскому применению вемурафениба.
Стандартный режим дозирования
Рекомендуемая доза препарата Котеллик составляет 60 мг (три таблетки по 20 мг) внутрь, один раз в сутки.
Препарат Котеллик необходимо принимать 28-дневными циклами.
Каждая доза препарата Котеллик состоит из трех таблеток по 20 мг (60 мг), и ее следует принимать один раз в сутки в течение 21 дня (период лечения с 1 по 21 день) с последующим 7-дневным перерывом в лечении препаратом Котеллик (перерыв в лечении с 22 по 28 день).
Каждую дозу (три таблетки по 20 мг на один прием) можно принимать независимо от приема пищи.
Таблетки препарата Котеллик следует проглатывать целиком, запивая водой.
Продолжительность лечения
Лечение препаратом Котеллик следует продолжать до тех пор, пока сохраняется польза для пациента или до развития непереносимой токсичности.
Задержка приема или пропущенные дозы
В случае если до приема следующей дозы осталось 12 и более часов, следует принять препарат Котеллик с целью сохранения схемы лечения с приемом один раз в сутки. Если до приема следующей дозы осталось менее 12 часов, лечение следует продолжить на следующий день согласно назначенной схеме.
Рвота
В случае возникновения рвоты после приема препарата Котеллик не следует принимать дополнительную дозу препарата в тот же день, а следует продолжить лечение согласно назначенной схеме на следующий день.
Изменение дозы
Изменение дозы препарата Котеллик должно основываться на оценке лечащим врачом безопасности и переносимости препарата у конкретного пациента.
Если пропуск дозы связан с появлением токсичности, пропущенные дозы не следует восполнять.
После снижения дозы препарата в дальнейшем не следует вновь повышать дозу.
Изменение дозы препарата Котеллик не зависит от изменения дозы вемурафениба.
Решение об уменьшении дозы одного или обоих препаратов должно быть основано на клинической оценке.
В таблице 1 ниже приведены общие рекомендации по изменению дозы препарата Котеллик.
Таблица 1. Общие рекомендации по снижению дозы препарата Котеллик.
| Степень тяжести нежелательных явлений* | Рекомендованная доза препарата Котеллик |
| Степень 1 или степень 2 (переносимая) | Без снижения дозы. |
| Степень 2 (непереносимая) или степень 3/4 | |
| 1 проявление | Прерывание лечения до ≤1 степени тяжести нежелательных явлений, возобновление терапии в дозе 40 мг один раз в сутки |
| 2 проявление | Прерывание лечения до ≤1 степени тяжести нежелательных явлений, возобновление терапии в дозе 20 мг один раз в сутки |
| 3 проявление | Рассмотреть прекращение лечения |
* Степень тяжести нежелательных явлений в соответствии с Общими критериями токсичности нежелательных явлений Национального института рака США, версия 4.0
Изменение дозы при развитии отдельных нежелательных реакций
Кровотечение
При возникновении кровотечений 4 степени тяжести или кровоизлияния в мозг (всех степеней) следует прервать лечение препаратом Котеллик. Если возникновение кровотечения связано с применением препарата Котеллик, терапия данным препаратом должна быть полностью прекращена.
При развитии кровотечений 3 степени тяжести следует прервать лечение препаратом Котеллик. Решение о возобновлении терапии должно быть принято лечащим врачом на основании оценки клинической картины. Данные касательно эффективности модификации дозы препарата Котеллик в случае возникновения кровотечений отсутствуют.
Лечение вемурафенибом может быть продолжено при прерывании лечения препаратом Котеллик (при наличии клинических показаний).
Дисфункция левого желудочка
Следует рассмотреть необходимость полного прекращения лечения препаратом Котеллик, если симптомы со стороны сердца связаны с лечением данным препаратом и в том случае, если не произошло улучшения после временного прерывания лечения.
Таблица 2. Изменение дозы препарата Котеллик у пациентов со снижением фракции выброса левого желудочка (ФВЛЖ) по сравнению с исходным показателем.


При изменении дозы препарата Котеллик лечение вемурафенибом может быть продолжено (при наличии клинических показаний). Рабдомиолиз и повышение активности креатинфосфокиназы
• При возникновении рабдомиолиза или симптоматического повышения активности креатинфосфокиназы (КФК) лечение препаратом Котеллик следует прервать. Если тяжесть уменьшилась, по меньшей мере, на одну степень в течение 4 недель, применение препарата Котеллик следует возобновить в дозе, сниженной на 20 мг, в соответствии с клиническими показаниями. Лечение вемурафенибом может быть продолжено при изменении схемы терапии препаратом Котеллик (при наличии клинических показаний). Лечение препаратом Котеллик следует полностью прекратить, если тяжесть рабдомиолиза или симптоматического повышения активности КФК не снизилась в течение 4 недель.
• Бессимптомное повышение активности КФК:
≤3 степени тяжести: у пациентов с бессимптомным повышением активности КФК нет необходимости изменять дозу препарата Котеллик или прерывать его прием. 4 степень тяжести: лечение препаратом Котеллик следует прервать. Если тяжесть явления уменьшилась до ≤3-й степени в течение 4 недель, применение препарата Котеллик в соответствии с клиническими показаниями следует возобновить в дозе, сниженной на 20 мг. Лечение вемурафенибом может быть продолжено при изменении схемы терапии препаратом Котеллик (при наличии клинических показаний). Лечение препаратом Котеллик следует полностью прекратить, если активность КФК не снизилась до ≤3-й степени в течение 4 недель после прерывания терапии. Отклонения лабораторных показателей функции печени
В случае отклонений лабораторных показателей функции печени 1 и 2 степени тяжести лечение препаратом Котеллик и вемурафенибом следует продолжить в назначенной дозе.
3 степень тяжести: следует продолжить лечение препаратом Котеллик в назначенной дозе. Доза вемурафениба может быть снижена в соответствии с клиническими показаниями (см. инструкцию по медицинскому применению вемурафениба).
4 степень тяжести: лечение препаратом Котеллик и вемурафенибом следует прервать. Если отклонения лабораторных показателей функции печени уменьшились до ≤1 степени тяжести в течение 4 недель, применение препарата Котеллик следует возобновить в дозе, сниженной на 20 мг, применение вемурафениба следует возобновить в соответствии с клиническими показаниями согласно инструкции по медицинскому применению вемурафениба.
Лечение препаратом Котеллик и вемурафенибом следует прекратить, если отклонения лабораторных показателей функции печени не уменьшились до ≤1 степени тяжести в течение 4 недель или отклонения лабораторных показателей функции печени 4 степени тяжести возобновляются после первоначального улучшения.
Фоточувствительность
Ведение пациентов с фоточувствительностью ≤2 степени тяжести (переносимой) должно включать поддерживающую терапию.
В случае развития фоточувствительности 2 степени (непереносимой) или ≥3 степени лечение препаратом Котеллик и вемурафенибом необходимо прервать до уменьшения тяжести симптомов до ≤1 степени. Лечение может быть возобновлено без изменения дозы препарата Котеллик.
Дозу вемурафениба необходимо снизить согласно инструкции по применению вемурафениба (см. инструкцию по медицинскому применению вемурафениба).
Сыпь
Сыпь может возникать как на фоне лечения препаратом Котеллик, так и вемурафенибом.
При развитии сыпи лечение препаратом Котеллик и/или вемурафенибом может быть временно прервано и/или возможно снижение дозы одного из препаратов или обоих препаратов по клиническим показаниям.
Дополнительно, при развитии сыпи:
- ≤2 степени (переносимой) — ведение пациентов должно включать поддерживающую терапию, лечение препаратом Котеллик может быть продолжено без изменения дозы;
- 2 степени (непереносимой) или ≥3 степени:
- акнеиформная сыпь: необходимо следовать общим рекомендациям по изменению дозы препарата Котеллик согласно таблице 1; лечение вемурафенибом может быть продолжено при изменении схемы терапии препаратом Котеллик (при наличии клинических показаний);
- неакнеиформная или макуло-папулезная сыпь: лечение препаратом Котеллик может быть продолжено без изменения дозы (по клиническим показаниям); лечение вемурафенибом может быть временно прервано и/или его доза снижена (см. инструкцию по медицинскому применению вемурафениба).
Окклюзия вен сетчатки
В случае возникновения окклюзии вен сетчатки терапия препаратом Котеллик должна быть прекращена.
Дозирование в особых случаях
Пациенты пожилого возраста
Коррекции дозы препарата Котеллик у пациентов в возрасте ≥65 лет не требуется.
Пациенты детского возраста и подростки
Безопасность и эффективность препарата Котеллик у детей и подростков (<18 лет) не установлены.
Пациенты с нарушением функции почек
Согласно данным популяционного фармакокинетического анализа у пациентов с нарушением функции почек легкой или умеренной степени коррекции дозы не требуется.
Безопасность и эффективность препарата Котеллик у пациентов с тяжелым нарушением функции почек не установлены.
Нарушение функции печени
У пациентов с нарушением функции печени коррекция дозы не рекомендуется. При применении препарата Котеллик в комбинации с вемурафенибом могут отмечаться отклонения лабораторных показателей функции печени.
Побочное действие
Клинические исследования
У пациентов с поздними стадиями меланомы с BRAF V600 мутацией при применении препарата Котеллик в комбинации с вемурафенибом медиана времени до появления первых нежелательных явлений ≥3 степени составила 0.6 месяцев.
Для описания частоты нежелательных реакций используется следующая классификация: очень часто (≥10%), часто (≥1% и <10%), нечасто (≥0.1% и <1%), редко (≥0.01% и <0.1%), очень редко (<0.01%).
Ниже представлены нежелательные реакции (всех степеней), зарегистрированные при применении препарата Котеллик в комбинации с вемурафенибом.
Нарушения со стороны крови и лимфатической системы:
очень часто – анемия.
Нарушения со стороны органа зрения:
очень часто – серозная ретинопатия (включая явления хориоретинопатии и отслойки сетчатки, как показатель серозной ретинопатии), снижение остроты зрения; часто – расстройство зрения.
Нарушения со стороны желудочно-кишечного тракта:
очень часто – диарея, тошнота, рвота, стоматит.
Общие расстройства и нарушения в месте введения:
очень часто – пирексия, озноб.
Нарушения со стороны обмена веществ и питания:
часто – обезвоживание, гипофосфатемия, гипонатриемия, гипергликемия.
Доброкачественные, злокачественные и неуточненные новообразования (включая кисты и полипы):
часто – базальноклеточный рак, кожная плоскоклеточная карцинома*, кератоакантома*.
Нарушения со стороны кожи и подкожных тканей: очень часто – фоточувствительность (включает реакции фоточувствительности, солнечные ожоги, солнечный дерматит, актинический эластоз), сыпь, макуло-папулезная сыпь, акнеиформный дерматит, гиперкератоз*.
Нарушения со стороны сосудов:
очень часто – повышение артериального давления, кровотечение**.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения:
часто – пневмонит.
Лабораторные и инструментальные данные: очень часто – повышение активности креатинфосфокиназы (КФК), повышение активности аланинаминотрансферазы (АЛТ), повышение активности аспартатаминотрансферазы (АСТ), повышение активности гаммаглутамилтранспептидазы, повышение активности щелочной фосфатазы (ЩФ), гипокалиемия, гипоальбуминемия, гиперкалиемия, гипокальциемия, повышение концентрации креатинина, лимфопения, тромбоцитопения, повышение концентрации билирубина; часто – снижение фракции выброса.
* См. подраздел «Кожная плоскоклеточная карцинома, кератоакантома и гиперкератоз».
**См. подраздел «Кровотечение».
Дополнительная информация по отдельным нежелательным реакциям
Кровотечение
Явления кровотечения (всех видов и степеней тяжести) чаще регистрировали при применении препарата Котеллик в комбинации с вемурафенибом по сравнению с контрольной группой, получавшей монотерапию вемурафенибом (13% по сравнению с 7%). При применении препарата Котеллик в комбинации с вемурафенибом наблюдалась более высокая частота кровоизлияний в мозг (1% по сравнению с 0%), кровотечений из желудочно-кишечного тракта (ЖКТ) (4% по сравнению с 1%), кровотечений из органов репродуктивной системы (2% по сравнению с <1%) и гематурии (3% по сравнению с 1%).
Большинство явлений относились к 1 или 2 степени и были несерьезными (12% по сравнению с 7%) и разрешились полностью или частично без изменения дозы препарата Котеллик. Явления 3-4 степени развились у 1% пациентов в каждой из групп.
Фоточувствительность
Реакции фоточувствительности наблюдались с более высокой частотой при применении препарата Котеллик в комбинации с вемурафенибом по сравнению с контрольной группой, получавшей монотерапию вемурафенибом (47% по сравнению с 35%).
Большинство явлений были 1 или 2 степени, а явления ≥3 степени возникали у 4% пациентов при применении препарата Котеллик в комбинации с вемурафенибом и не наблюдались в контрольной группе (0%).
Не наблюдалось каких-либо закономерностей по времени до возникновения явлений ≥3 степени. При возникновении явлений фоточувствительности ≥3 степени у пациентов, получавших препарат Котеллик в комбинации с вемурафенибом, проводили преимущественно местную терапию в сочетании с прерыванием терапии обоими препаратами.
При проведении монотерапии кобиметинибом не наблюдалось признаков фототоксичности.
Кожная плоскоклеточная карцинома, кератоакантома и гиперкератоз
При применении препарата Котеллик в комбинации с вемурафенибом по сравнению с контрольной группой, получавшей монотерапию вемурафенибом, реже регистрировали следующие нежелательные явления: кожную плоскоклеточную карциному (всех степеней: 3% по сравнению с 13%), кератоакантому (всех степеней: 2% по сравнению с 9%), гиперкератоз (всех степеней: 11% по сравнению с 30%).
Серозная ретинопатия
У пациентов, получавших препарат Котеллик, отмечались случаи серозной ретинопатии.
Пациентам, у которых впервые возникли или усилились нарушения зрения, рекомендовано пройти офтальмологическое обследование. Ведение пациентов с серозной ретинопатией включает прерывание лечения, снижение дозы или прекращение терапии.
Окклюзия вен сетчатки отмечалась у одного пациента в каждой из групп терапии (в группе применения препарата Котеллик в комбинации с вемурафенибом и в контрольной группе, получавшей монотерапию вемурафенибом).
Дисфункция левого желудочка
У пациентов, получавших препарат Котеллик, отмечалось снижение фракции выброса левого желудочка (ФВЛЖ) относительно исходного показателя.
ФВЛЖ необходимо оценивать перед началом лечения для определения исходных значений, затем через месяц лечения и, как минимум, каждые 3 месяца или по клиническим показаниям до прекращения лечения. Ведение пациентов со снижением ФВЛЖ относительно исходного уровня включает прерывание лечения, снижение дозы или прекращение терапии.
Отклонения лабораторных показателей
Отклонения лабораторных показателей функции печени
У пациентов, получавших препарат Котеллик в комбинации с вемурафенибом, отмечались отклонения лабораторных показателей функции печени, особенно, АЛТ, АСТ, ЩФ. Лабораторные показатели функции печени необходимо оценивать перед началом комбинированного лечения, ежемесячно во время лечения или чаще (при наличии клинических показаний).
Повышение активности КФК
Бессимптомное повышение активности КФК крови чаще встречалось при применении препарата Котеллик в комбинации с вемурафенибом по сравнению с контрольной группой, получавшей монотерапию вемурафенибом (всех степеней: 70% по сравнению с 14%; 3-4 степени: 12% по сравнению с <1%). Было отмечено по одному случаю рабдомиолиза с одновременным повышением активности КФК крови в каждой из групп.
Пострегистрационное применение
При пострегистрационном применении препарата Котеллик отмечались следующие нежелательные лекарственные реакции.
Нарушения со стороны скелетно-мышечной и соединительной ткани: рабдомиолиз.
Передозировка
В клинических исследованиях не наблюдалось случаев передозировки. В случае предполагаемой передозировки лечение препаратом Котеллик следует приостановить и начать проведение поддерживающей терапии. Специфического антидота, который можно было бы использовать в случаях передозировки препаратом Котеллик, не существует.
Взаимодействие с другими лекарственными средствами
Влияние сопутствующих лекарственных препаратов на кобиметиниб
Ингибиторы изофермента CYP3A
Кобиметиниб метаболизируется с участием изофермента CYP3A. У здоровых лиц в присутствии мощного ингибитора изофермента CYP3A (итраконазола) AUC кобиметиниба увеличивается приблизительно в 7 раз. Существует вероятность, что магнитуда взаимодействия у пациентов будет ниже.
Мощные ингибиторы изофермента CYP3A
Следует избегать одновременного применения мощных ингибиторов изофермента CYP3A при лечении кобиметинибом. Примеры мощных ингибиторов изофермента CYP3A включают, но не ограничиваются ритонавиром, кобицистатом, телапревиром, лопинавиром, итраконазолом, вориконазолом, кларитромицином, телитромицином, позаконазолом, нефазодоном и грейпфрутовым соком. Если одновременного применения с мощным ингибитором изофермента CYP3A нельзя избежать, следует тщательно следить за безопасностью пациентов. В случае кратковременного (≤7 дней) применения мощных ингибиторов изофермента CYP3A следует рассмотреть возможность приостановки лечения кобиметинибом во время применения такого ингибитора.
Умеренные ингибиторы изофермента CYP3A
Следует соблюдать осторожность при применении кобиметиниба одновременно с умеренными ингибиторами изофермента CYP3A. Примеры умеренных ингибиторов изофермента CYP3A включают, но не ограничиваются амиодароном, эритромицином, флуконазолом, миконазолом, дилтиаземом, верапамилом, делавирдином, ампренавиром, фосампренавиром, иматинибом. При одновременном применении кобиметиниба с умеренным ингибитором изофермента CYP3A следует тщательно следить за безопасностью пациентов.
Слабые ингибиторы изофермента CYP3A
Кобиметиниб можно применять одновременно со слабыми ингибиторами изофермента CYP3A без коррекции дозы.
Индукторы изофермента CYP3A
Одновременное применение кобиметиниба с мощным индуктором изофермента CYP3A не оценивалось в ходе клинического исследования, однако вероятно снижение экспозиции кобиметиниба. Таким образом, одновременного применения умеренных и мощных индукторов изофермента CYP3A (например, карбамазепин, рифампицин, фенитоин и зверобой продырявленный) следует избегать. Необходимо рассмотреть возможность применения препаратов, с отсутствующей или минимальной индукцией изофермента CYP3A, в качестве альтернативы. Эффективность может быть снижена, поскольку существует вероятность значительного уменьшения концентрации кобиметиниба при одновременном применении с умеренными и мощными индукторами изофермента CYP3A.
Ингибиторы Р-гликопротеина
Кобиметиниб является субстратом Р-гликопротеина. При одновременном применении с ингибиторами Р-гликопротеина, такими как циклоспорин и верапамил, существует вероятность повышения концентрации кобиметиниба в плазме крови.
Препараты, понижающие кислотность
Одновременное применение ингибитора протонного насоса не оказывает влияния на фармакокинетику кобиметиниба. Для определения влияния повышения рН желудка кобиметиниб назначали здоровым лицам совместно с рабепразолом (ингибитором протонного насоса). При этом повышение рН желудка не влияло на всасывание кобиметиниба.
Влияние кобиметиниба на сопутствующие лекарственные препараты
Субстраты изоферментов CYP3А и CYP2D6
Клиническое исследование лекарственных взаимодействий у пациентов с онкологическим заболеванием показало, что в присутствии кобиметиниба концентрации мидазолама (чувствительного субстрата CYP3A) и декстрометорфана (чувствительного субстрата CYP2D6) в плазме крови не менялись.
Субстраты изофермента CYP1А2
Кобиметиниб является потенциальным индуктором изофермента CYP1А2 in vitro, таким образом, вероятно снижение экспозиции субстратов данного фермента, например, теофиллина. Клинических исследований лекарственных взаимодействий для оценки клинической значимости данного явления не проводилось.
Субстраты BCRP (breast cancer resistance protein — белок устойчивости рака молочной железы)
Кобиметиниб является умеренным ингибитором BCRP in vitro. Клинических исследований лекарственных взаимодействий для оценки данного явления не проводилось. Клиническая значимость ингибирования интестинального BCRP не может быть исключена.
Другие противоопухолевые препараты
Вемурафениб
У пациентов с неоперабельной или метастатической меланомой не отмечено клинически значимых лекарственных взаимодействий между препаратом Котеллик и вемурафенибом, таким образом, коррекция дозы не рекомендуется.
Влияние кобиметиниба на транспортные системы лекарственных препаратов
В исследованиях in vitro показано, что кобиметиниб не является субстратом транспортных белков OATP1B1, OATP1B3 и OCT1, являясь слабым ингибитором этих транспортных белков. Клиническая значимость этих данных не установлена.
Особые указания
При применении препарата Котеллик в комбинации с вемурафенибом необходимо также внимательно ознакомиться с инструкцией по медицинскому применению вемурафениба.
Котеллик в комбинации с вемурафенибом у пациентов с прогрессированием заболевания при применении ингибитора BRAF
Данные по применению препарата Котеллик в комбинации с вемурафенибом у пациентов с прогрессированием заболевания, которые ранее применяли ингибитор BRAF, ограничены. Согласно этим данным эффективность комбинации у таких пациентов будет ниже.
Таким образом, следует рассмотреть альтернативные способы лечения перед применением комбинации в данной группе пациентов, которые ранее применяли ингибитор BRAF. Последовательность лечения после прогрессирования заболевания при применении ингибитора BRAF не установлена.
Препарат Котеллик в комбинации с вемурафенибом у пациентов с метастазами головного мозга
Оценки безопасности и эффективности лечения препаратом Котеллик в комбинации с вемурафенибом у пациентов с метастатической меланомой (при наличии BRAF V600 мутации) с метастазами в головной мозг не проводилось. Интракраниальная активность кобиметиниба на данный момент неизвестна.
Кровотечение
При применении препарата Котеллик могут отмечаться кровотечения, включая массивные (сопровождающиеся симптомами в критичной области или органе).
Следует соблюдать осторожность при лечении пациентов с дополнительными факторами риска кровотечений, такими как метастазы в головной мозг, и/или пациентов, которые одновременно применяют лекарственные средства, повышающие риск кровотечений (включая антитромботические и антикоагулянтные средства).
Рекомендации по ведению пациентов, у которых возникли кровотечения, представлены в разделе «Способ применения и дозы».
Серозная ретинопатия
У пациентов, получавших ингибиторы MEK, включая Котеллик, наблюдались случаи серозной ретинопатии (скопление жидкости в пределах слоев сетчатки). Большинство явлений включали хориоретинопатию или отслойку сетчатки.
Медиана времени до первого появления серозной ретинопатии составляет 1 месяц (диапазон 0-9 месяцев). Большинство явлений, наблюдавшихся в клинических исследованиях, разрешились, или их тяжесть уменьшилась до бессимптомного течения 1 степени после прерывания лечения или снижения дозы.
Необходимо проводить оценку новых симптомов или усиления расстройства зрения у пациентов при каждом визите. Пациентам, у которых впервые возникли или усилились расстройства зрения, рекомендовано пройти офтальмологическое обследование. В случае диагностики серозной ретинопатии следует приостановить лечение препаратом Котеллик до облегчения тяжести зрительных симптомов до ≤1 степени. Ведение пациентов с серозной ретинопатией включает прерывание лечения, снижение дозы или прекращение терапии.
Дисфункция левого желудочка
У пациентов, получающих Котеллик, отмечалось снижение фракции выброса левого желудочка (ФВЛЖ) относительно исходного показателя. Медиана времени до первого возникновения явлений составляет 4 месяца (1-13 месяцев). ФВЛЖ необходимо оценивать перед началом лечения для определения исходных значений, затем через месяц лечения и, как минимум, каждые 3 месяца или по клиническим показаниям до прекращения лечения. Ведение пациентов со снижением ФВЛЖ относительно исходного уровня включает прерывание лечения, снижение дозы или прекращение терапии.
У всех пациентов, которым было возобновлено лечение препаратом Котеллик в более низкой дозе, необходимо проводить измерение ФВЛЖ по возможности через 2 недели, 4 недели, 10 недель и 16 недель, а затем по клиническим показаниям.
Пациенты с исходным значением ФВЛЖ ниже нижней границы нормы учреждения или ниже 50% не изучались.
Отклонения лабораторных показателей функции печени
При применении препарата Котеллик в комбинации с вемурафенибом, а также при монотерапии вемурафенибом (см. инструкцию по медицинскому применению вемурафениба), могут отмечаться отклонения лабораторных показателей функции печени. У пациентов, получавших препарат Котеллик в комбинации с вемурафенибом, отмечались отклонения лабораторных показателей функции печени, особенно, АЛТ, АСТ, ЩФ.
Отклонения показателей функции печени необходимо оценивать по результатам лабораторных исследований перед началом комбинированного лечения, ежемесячно во время лечения или чаще (при наличии клинических показаний).
Ведение пациентов с отклонениями лабораторных показателей функции печени 3 степени тяжести включает прерывание лечения или снижение дозы вемурафениба. Ведение пациентов с отклонениями лабораторных показателей функции печени 4 степени тяжести включает прерывание лечения, снижение дозы или прекращение терапии как препаратом Котеллик, так и вемурафенибом.
Рабдомиолиз и повышение активности КФК
У пациентов, получавших препарат Котеллик, отмечались случаи рабдомиолиза.
Если диагностирован рабдомиолиз, лечение препаратом Котеллик следует прервать и мониторировать его симптомы и активность КФК до их разрешения. В зависимости от степени тяжести рабдомиолиза может потребоваться снижение дозы или прекращение лечения.
Повышение активности КФК 3 и 4 степени, включая бессимптомное повышение по сравнению с исходным уровнем, отмечалось у пациентов, получающих препарат
Котеллик в комбинации с вемурафенибом в клинических исследованиях. Медиана времени до первого повышения активности КФК 3 или 4 степени составила 16 дней (11 дней – 10 месяцев); медиана времени до полного разрешения составила 16 дней (2 дня – 15 месяцев).
Показатели креатинина и КФК сыворотки необходимо измерять перед началом лечения для определения исходных значений, затем каждый месяц во время лечения или по клиническим показаниям.
Если активность КФК сыворотки повышена по сравнению с исходным уровнем, следует провести оценку наличия признаков и симптомов рабдомиолиза или других причин, вызвавших повышение данного лабораторного показателя.
В зависимости от тяжести симптомов или степени повышения КФК может потребоваться перерыв в лечении, снижение дозы или прекращение терапии.
Диарея
У пациентов, получавших лечение препаратом Котеллик, были отмечены случаи тяжелой диареи и диареи ≥3 степени тяжести. Ведение пациентов с диареей включает в себя применение противодиарейных средств и поддерживающую терапию. При диарее ≥3 степени тяжести, возникшей, несмотря на применение поддерживающей терапии, следует приостановить лечение препаратом Котеллик и вемурафенибом до тех пор, пока не будет отмечено снижение тяжести явления до ≤1 степени. При возобновлении диареи ≥3 степени тяжести необходимо снизить дозу препарата Котеллик и вемурафениба.
Непереносимость лактозы
Препарат содержит лактозу. Пациентам с редкой наследственной непереносимостью галактозы, врожденной недостаточностью лактазы или глюкозо-галактозной мальабсорбцией следует проконсультироваться с лечащим врачом для индивидуального обсуждения случаев, когда польза превосходит риски.
Взаимодействие с ингибиторами изофермента CYP3A
Следует избегать одновременного применения препарата Котеллик с мощными ингибиторами изофермента CYP3A. Следует соблюдать осторожность при применении кобиметиниба одновременно с умеренными ингибиторами изофермента CYP3A. Если одновременного применения с мощным или умеренным ингибитором изофермента CYP3A нельзя избежать, следует тщательно следить за безопасностью пациентов, а также при необходимости снижать дозу согласно рекомендациям, представленным в таблице 1.
Уничтожение неиспользованного препарата или препарата с истекшим сроком годност и должно проводиться в соответствии с локальными требованиями.
Влияние на способность к вождению транспортных средств и работу с машинами и механизмами
Исследования влияния препарата Котеллик на способность к вождению транспортных средств и работу с машинами и механизмами не проводились.
Во время проведения клинических исследований у пациентов, получавших препарат Котеллик, были зарегистрированы расстройства зрения. Пациентам в случае нарушений со стороны зрения не следует управлять транспортными средствами и работать с машинами и механизмами без консультации врача.
Форма выпуска
Таблетки, покрытые пленочной оболочкой, 20 мг
По 21 таблетке в блистер из дуплекса (ПВХ/ПВДХ) и фольги алюминиевой.
3 блистера вместе с инструкцией по применению помещают в картонную пачку. С целью контроля первого вскрытия на упаковку наносится защитная голографическая наклейка.
Срок годности
3 года.
Не использовать по истечении срока годности, указанного на упаковке.
Условия хранения
Хранить при температуре не выше 30°С. Хранить в недоступном для детей месте.
Условия отпуска из аптек
По рецепту.
Владелец Регистрационного удостоверения
Ф. Хоффманн-Ля Рош Лтд., Швейцария
F. Hoffmann-La Roche Ltd, Grenzacherstrasse 124, 4070 Basel, Switzerland
Производитель
Ф. Хоффманн-Ля Рош Лтд., Швейцария
F. Hoffmann-La Roche Ltd, Grenzacherstrasse 124, 4070 Basel, Switzerland
Претензии потребителей направлять в компанию ЗАО «Рош-Москва» по адресу:
107031, Россия, г. Москва, Трубная площадь, д. 2
Купить Котеллик в megapteka.ru
*Цены в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
