Гемцитабин (лиофилизат для приготовления раствора для инфузий, 200 мг), инструкция по медицинскому применению РУ № ЛП-004959
Дата последнего изменения: 26.10.2021
Особые отметки:
Содержание
- Действующее вещество
- ATX
- Нозологическая классификация (МКБ-10)
- Фармакологическая группа
- Лекарственная форма
- Состав
- Описание лекарственной формы
- Фармакокинетика
- Фармакодинамика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Производитель
- Аналоги (синонимы) препарата Гемцитабин
Действующее вещество
ATX
Нозологическая классификация (МКБ-10)
Список кодов МКБ-10
- C25 Злокачественное новообразование поджелудочной железы
- C34 Злокачественное новообразование бронхов и легкого
- C50 Злокачественные новообразования молочной железы
- C53 Злокачественное новообразование шейки матки
- C56 Злокачественное новообразование яичника
- C65 Злокачественное новообразование почечных лоханок
- C66 Злокачественное новообразование мочеточника
- C67 Злокачественное новообразование мочевого пузыря
- C68.0 Уретры
- C78.0 Вторичное злокачественное новообразование легкого
- C78.8 Вторичное злокачественное новообразование других и неуточненных органов пищеварения
- C79.0 Вторичное злокачественное новообразование почки и почечных лоханок
- C79.1 Вторичное злокачественное новообразование мочевого пузыря, других и неуточненных мочевых органов
- C79.6 Вторичное злокачественное новообразование яичника
- C79.8 Вторичное злокачественное новообразование других уточненных локализаций
Фармакологическая группа
Лекарственная форма
Лиофилизат
для приготовления концентрата для приготовления раствора для инфузий.
Состав
Состав
на один флакон 10 мл:
Действующее вещество:
Гемцитабин
(в виде гемцитабина гидрохлорида — 228 мг) — 200 мг;
Вспомогательные вещества:
Маннитол,
натрия ацетат (в виде натрия ацетата тригидрата), хлористоводородной кислоты
раствор 1 М.
Состав
на один флакон 50 мл:
Действующее вещество:
Гемцитабин
(в виде гемцитабина гидрохлорида — 1140 мг) — 1000 мг;
Вспомогательные вещества:
Маннитол,
натрия ацетат (в виде натрия ацетата тригидрата), хлористоводородной кислоты
раствор 1 М.
Описание лекарственной формы
Белый
или почти белый порошок в виде слоя или отдельных агрегатов или легкосыпучий
порошок.
Фармакокинетика
Максимальная
концентрация в плазме крови (наблюдавшаяся в течение 5 минут
до окончания инфузии) составляла от 3,2 до 45,5 мкг/мл. Концентрация
исходного вещества в плазме крови после введения препарата в дозе
1000 мг/м2 в течение 30 минут была выше 5 мкг/мл в
течение примерно 30 минут после завершения инфузии и выше 0,4 мкг/мл
еще в течение часа.
Распределение
Объем
распределения крови составлял 12,4 л/м2 у женщин и 17,5 л/м2
у мужчин (межвидовая вариабельность была равна 91,9%). Объем распределения
в других тканях составлял 47,4 л/м2 и не зависел от
половой принадлежности.
Связывание
с белками плазмы считалось незначительным.
Период
полувыведения составлял от 42 до 94 минут, в зависимости от возраста и пола.
Для рекомендованной схемы введения препарата выведение гемцитабина должно быть
практически завершено в течение периода от 5 до 11 часов после начала инфузии.
Гемцитабин не накапливается при введении один раз в неделю.
Метаболизм
Гемцитабин
быстро метаболизируется цитидиндезаминазой в печени, почках, крови и других
тканях. Вследствие внутриклеточного метаболизма гемцитабина образуются моно‑,
ди- и трифосфаты гемцитабина, из которых активными считаются ди- и трифосфаты.
Эти внутриклеточные метаболиты не были обнаружены в плазме или моче. Основной
метаболит, 2’‑дезокси-2′,2’‑дифторуридин, не активен и не
определяется в плазме и моче.
Выведение
Системный
клиренс находился в пределах от 29,2 л/ч/м2 до 92,2 л/ч/м2
в зависимости от пола и возраста (межвидовая вариабельность
составляла 52,2%). Клиренс у женщин был примерно на 25% ниже, чем у
мужчин. Оставаясь высоким, клиренс и у мужчин, и у женщин, по‑видимому,
снижается с возрастом. Для рекомендованной дозы гемцитабина 1000 мг/м2
при инфузионном введении в течение 30 минут более низкие значения клиренса
для женщин и мужчин не требуют снижения дозы гемцитабина.
Менее
10% выводится почками в неизмененном виде.
Почечный
клиренс составлял от 2 до 7 л/ч/м2.
В
течение недели после введения препарата выводится от 92 до 98% введенной дозы
гемцитабина, при этом 99% выводится почками, в основном в виде 2’‑дифторуридина,
а 1% дозы — через кишечник.
Кинетика трифосфатов гемцитабина
Данный
метаболит можно обнаружить в мононуклеарных клетках периферической крови, и
информация далее относится к этим клеткам. Внутриклеточные концентрации
повышаются пропорционально дозам гемцитабина в диапазоне от 35 до 350 мг/м2
в течение 30 минут, что обеспечивает равновесную концентрацию от 0,4
до 5 мкг/мл. При концентрации гемцитабина в плазме выше
5 мкг/мл уровень трифосфатов гемцитабина не повышается, на основании
чего можно предположить, что образование данного метаболита в мононуклеарных
клетках является насыщаемым.
Конечный
период полувыведения: от 0,7 до 12 часов.
Кинетика 2′-дезокси-2′,2′-дифторуридина
Максимальная
концентрация в плазме (через 3–15 минут после окончания 30‑минутной
инфузии, 1000 мг/м2) составляла от 28 до 52 мкг/мл.
Минимальная концентрация после введения один раз в неделю была равна
от 0,07 до 1,12 мкг/мл, без кажущегося накопления. Кривая «концентрация
в плазме-время» имеет трехфазную форму со средним периодом полувыведения в
конечной фазе — 65 часов (диапазон от 33 до 84 часов).
Образование
2’‑дезокси-2′,2’‑дифторуридина из исходного вещества: от 91 до 98%.
Средний
объем распределения в крови: 18 л/м2 (диапазон от 11 до
22 л/м2).
Средний
объем распределения в равновесном состоянии: 150 л/м2 (диапазон
от 96 до 228 л/м2).
Распределение
в тканях: обширное.
Средний
кажущийся клиренс: 2,5 л/ч/м2 (диапазон от 1 до 4 л/ч/м2).
Полностью
выводится почками.
Комбинированная терапия гемцитабином и паклитакселом
Комбинированная
терапия не оказывала влияния на фармакокинетику гемцитабина или паклитаксела.
Комбинированная терапия гемцитабином и карбоплатином
При
применении в комбинации с карбоплатином фармакокинетика гемцитабина не менялась.
Почечная недостаточность
Почечная
недостаточность легкой или средней степени тяжести (скорость клубочковой
фильтрации (СКФ) от 30 мл/мин до 80 мл/мин) не оказывает стабильного
значимого воздействия на фармакокинетику гемцитабина.
Фармакодинамика
Гемцитабин
представляет собой антиметаболит пиримидина. Препарат проявляет
фазоспецифичность, действуя на клетки в S фазе (фаза синтеза
дезоксирибонуклеиновой кислоты, ДНК), и при определенных обстоятельствах блокирует
развитие клеток на границе фаз G1/S.
Гемцитабин
метаболизируется внутри клетки под действием нуклеозидкиназы
с образованием активных дифосфатных и трифосфатных нуклеозидов.
Цитотоксическое действие гемцитабина проявляется за счет ингибирования синтеза
ДНК с помощью двух механизмов действия посредством дифосфатных и трифосфатных
нуклеозидов. Дифосфатные нуклеозиды ингибируют рибонуклеотидредуктазу, которая
действует в качестве единственного катализатора реакций, приводящих
к образованию дезоксинуклеозидтрифосфатов, необходимых для синтеза ДНК.
Ингибирование данного фермента посредством дифосфатных нуклеозидов снижает
концентрацию дезоксинуклеозидов в целом и дезоксинуклеозидтрифосфатов в
частности. Трифосфатные нуклеозиды активно конкурируют с дезоксинуклеозидтрифосфатами
за встраивание в молекулы ДНК.
Аналогичным
образом небольшое количество гемцитабина может также встраиваться
в молекулы рибонуклеиновой кислоты, РНК. Таким образом, сниженная
внутриклеточная концентрация дезоксинуклеозидтрифосфатов усиливает встраивание
трифосфатных нуклеозидов в ДНК. ДНК-полимераза эпсилон не обладает
способностью выводить гемцитабин и выполнять репарацию растущих цепей ДНК.
После того, как гемцитабин встраивается в ДНК, в растущие цепи ДНК
добавляется еще один нуклеотид. После такого добавления происходит почти полное
ингибирование дальнейшего синтеза ДНК (маскированная терминация цепи). После встраивания
в ДНК гемцитабин, по‑видимому, стимулирует запрограммированный процесс
гибели клеток, известный как апоптоз.
Показания
–
Местнораспространенный
или метастатический немелкоклеточный рак легкого в качестве терапии первой
линии в комбинации с цисплатином или карбоплатином, а также
в монотерапии у пожилых пациентов с функциональным статусом,
равным 2.
–
Нерезектабельный,
местнорецидивирующий или метастатический рак молочной железы в составе
комбинированной терапии с паклитакселом после проведения неоадъювантной и/или
адъювантной терапии с включением антрациклинов при отсутствии противопоказаний
к их назначению.
–
Местнораспространенный
или метастатический уротелиальный рак (рак мочевого пузыря, почечной лоханки,
мочеточника, мочеиспускательного канала).
–
Местнораспространенный
или метастатический эпителиальный рак яичников в качестве монотерапии или
в сочетании с карбоплатином у пациентов с прогрессированием
заболевания после проведения первой линии терапии на основе производных
платины.
–
Местнораспространенный
или метастатический рак поджелудочной железы.
–
Местнораспространенный
или метастатический рак шейки матки.
–
Рак
желчевыводящих путей.
Противопоказания
–
Повышенная
чувствительность к гемцитабину или другим компонентам препарата.
–
Беременность и
период кормления грудью.
–
Возраст до 18
лет.
С осторожностью
При
нарушении функции печени и/или почек, угнетении костномозгового кроветворения
(в том числе на фоне сопутствующей лучевой или химиотерапии у
пациентов с сердечно-сосудистыми заболеваниями (в том числе в анамнезе).
Применение при беременности и кормлении грудью
Беременность
Отсутствуют
достаточные данные о применении гемцитабина у беременных женщин.
В исследованиях на животных была показана репродуктивная токсичность.
Опираясь на данные доклинических исследований и механизм действия
гемцитабина, препарат не рекомендовано применять в течение беременности,
за исключением особой необходимости. Женщины детородного возраста должны
использовать надежные методы контрацепции во время лечения гемцитабином и
незамедлительно предупреждать своего лечащего врача в случае наступления беременности.
Период грудного вскармливания
Данных
о возможности проникновения гемцитабина в грудное молоко нет. Также неизвестно,
какие нежелательные реакции может вызвать препарат при попадании в организм
ребенка с молоком матери. Грудное вскармливание должно быть прекращено во время
лечения гемцитабином.
Влияние на репродуктивность
В
испытаниях у самцов мышей введение гемцитабина вызывало гипосперматогенез. По этой
причине, мужчинам, получающим лечение гемцитабином, необходимо использовать
эффективные методы контрацепции во время терапии и в течение 6 месяцев
после прекращения терапии. Также пациентам рекомендуется обращение за дополнительной
консультацией по криоконсервации спермы до начала лечения, поскольку
существует вероятность бесплодия из-за лечения гемцитабином.
Способ применения и дозы
Лечение
гемцитабином можно проводить только под наблюдением врача, имеющего опыт
применения противоопухолевой химиотерапии.
Гемцитабин
вводится внутривенно капельно в течение 30 минут.
Перед
каждым введением гемцитабина необходимо контролировать количество тромбоцитов,
лейкоцитов и гранулоцитов в крови. При признаках угнетения функции костного
мозга, вызванного препаратом, необходимо приостановить лечение или
скорректировать дозу.
Немелкоклеточный рак легкого
(местнораспространенный или метастатический) первая линия терапии
Монотерапия:
рекомендованная доза препарата — 1000 мг/м2 в 1, 8 и 15 дни
каждого 28‑дневного цикла.
Комбинированная терапия с цисплатином:
рекомендованная доза препарата — 1250 мг/м2 в 1 и 8 день
каждого 21‑дневного цикла или 1000 мг/м2 в 1, 8 и
15 дни каждого 28‑дневного цикла. Цисплатин вводится в дозе
70 мг/м2 в 1 день цикла после инфузии гемцитабина на фоне
гипергидратации.
Комбинированная терапия с карбоплатином:
рекомендованная доза препарата — 1000 мг/м2 или
1200 мг/м2 в 1 и 8 день каждого 21‑дневного цикла.
Карбоплатин
вводится из расчета AUC (площадь под кривой «концентрация-время»)
5,0 мг/мл/мин в 1 день цикла после инфузии гемцитабина.
Рак молочной железы
(нерезектабельный, местнорецидивирующий или метастатический)
Комбинированная терапия с паклитакселом:
в качестве терапии первой линии при прогрессировании заболевания после
неоадъювантной и/или адъювантной терапии, включающей антрациклины, при
отсутствии противопоказаний к ним. Паклитаксел вводится в дозе 175 мг/м2
внутривенно капельно в течение 3 часов в 1 день 21‑дневного цикла с
последующим введением гемцитабина. Рекомендованная доза препарата —
1250 мг/м2 в 1 и 8 день каждого 21‑дневного цикла.
Перед
началом комбинированной терапии (гемцитабин + паклитаксел) абсолютное число
гранулоцитов в крови у пациентов должно быть не менее 1500/мкл.
Уротелиальный рак
(рак мочевого пузыря (местнораспространенный, метастатический и поверхностный),
почечной лоханки, мочеточника, мочеиспускательного канала)
Монотерапия:
рекомендованная доза препарата — 1250 мг/м2 в 1, 8 и 15 дни
каждого 28‑дневного цикла.
Комбинированная терапия с цисплатином:
рекомендованная доза препарата — 1000 мг/м2 в 1, 8 и
15 дни в сочетании с цисплатином, который вводится в дозе 70 мг/м2
сразу после инфузии гемцитабина в 1 или во 2 день каждого 28‑дневного
цикла. Клинические исследования показали, что при дозе цисплатина 100 мг/м2
наблюдается более выраженная миелосупрессия.
Эпителиальный рак яичников
(местнораспространенный или метастатический, резистентный к производным
платины)
Монотерапия:
рекомендованная доза препарата — 800–1250 мг/м2 в 1, 8 и 15 дни
каждого 28‑дневного цикла.
Комбинированная терапия с карбоплатином:
рекомендованная доза препарата — 1000 мг/м2 в 1 и
8 день в сочетании с карбоплатином из расчета AUC 4,0 мг/мл/мин,
который вводится сразу после инфузии гемцитабина в 1 день каждого 21‑дневного
цикла.
Рак поджелудочной железы
(местнораспространенный или метастатический, в т. ч. резистентный
к терапии фторурацилом)
Монотерапия:
рекомендованная доза препарата — 1000 мг/м2 один раз в неделю
в течение 7 недель с последующим недельным перерывом. Затем
препарат вводится в 1, 8 и 15 дни каждого 28‑дневного цикла.
Рак шейки матки
(местнораспространенный или метастатический)
Комбинированная терапия с цисплатином:
при местнораспространенном раке при последовательной химиолучевой терапии
(неоадъювантно) и при метастатическом раке цисплатин вводится в дозе
70 мг/м2 в 1 день цикла на фоне гипергидратации с последующим
введением гемцитабина. Гемцитабин вводится в дозе 1250 мг/м2 в
1 и 8 день каждого 21‑дневного цикла.
При
местнораспространенном раке при одновременной химиолучевой терапии цисплатин
вводится в дозе 40 мг/м2 с последующим (непосредственно
после введения цисплатина) введением гемцитабина. Гемцитабин вводится 1 раз в
неделю за 1–2 часа до начала лучевой терапии в дозе 125 мг/м2.
Рак желчевыводящих путей
Комбинированная терапия с цисплатином:
цисплатин вводится в дозе 70 мг/м2 в 1 день цикла
на фоне гипергидратации с последующим введением гемцитабина. Гемцитабин
вводится в дозе 1250 мг/м2 в 1 и 8 день каждого 21‑дневного
цикла.
Коррекция дозы
Коррекция дозы по причине гематологической токсичности
При
любом показании перед каждым введением гемцитабина необходимо контролировать
количество тромбоцитов и гранулоцитов в крови.
В
случае развития гематологической токсичности доза гемцитабина может быть
уменьшена, либо его введение отложено в соответствии со следующими схемами:
А.
|
Коррекция |
|||
|
Абсолютное |
Количество |
% от |
|
|
>1 |
и |
>100 |
100 |
|
0,5–1 |
или |
50–100 |
75 |
|
<0,5 |
или |
<50 |
пропустить |
* Пропущенная
доза не должна вводиться в течение цикла до тех пор, пока абсолютное число
гранулоцитов не достигнет показателя как минимум 0,5 ? 109/л,
а число тромбоцитов не достигнет показателя 50 ? 109/л.
Б.
|
Коррекция |
|||
|
Абсолютное |
Количество |
% от |
|
|
≥1,2 |
и |
>75 |
100 |
|
1–1,2 |
или |
50–175 |
75 |
|
0,7–<1 |
и |
≥50 |
50 |
|
<0,7 |
или |
<50 |
пропустить |
* Пропущенная
доза не должна вводиться в течение цикла. Терапия начнется в 1 день
следующего цикла, как только абсолютное число гранулоцитов достигнет показателя
как минимум 1,5 ? 109/л, а число тромбоцитов
достигнет показателя 100 ? 109/л.
В.
|
Коррекция |
|||
|
Абсолютное |
Количество |
% от |
|
|
>1,5 |
и |
≥100 |
100 |
|
1–0,5 |
или |
75–100 |
50 |
|
<1 |
или |
<75 |
пропустить |
* Пропущенная
доза не должна вводиться в течение цикла. Терапия начнется в 1 день
следующего цикла, как только абсолютное число гранулоцитов достигнет показателя
как минимум 1,5 ? 109/л, а число тромбоцитов
достигнет показателя 100 ? 109/л.
При
любом показании в последующих циклах доза гемцитабина должна быть снижена до 75%
от начальной дозы первого цикла при наличии следующих видов
гематологической токсичности:
–
абсолютное число
гранулоцитов <500 ? 106/л в течение более
5 дней;
–
абсолютное число
гранулоцитов <100 ? 106/л в течение более
3 дней;
–
фебрильная
нейтропения;
–
число
тромбоцитов <25 ? 109/л;
–
задержка цикла
лечения более чем на 1 неделю вследствие токсичности.
Для выявления негематологической токсичности
необходимо проводить регулярное обследование пациента и контролировать функцию
печени и почек. В зависимости от степени токсичности дозу можно
снижать с каждым циклом или в течение цикла.
Как
правило, при тяжелой (3 или 4 степени) негематологической токсичности, за исключением
случаев тошноты/рвоты, терапию гемцитабином следует временно прекратить или
уменьшить дозу препарата на основании решения лечащего врача. Терапия
должна быть приостановлена до тех пор, пока, по мнению врача, токсичность
не разрешиться.
Для
получения информации о коррекции дозы цисплатина, карбоплатина и паклитаксела
при комбинированной терапии следует обратиться к соответствующим инструкциям
по медицинскому применению.
Особые группы пациентов
Пожилые пациенты (старше 65 лет)
Гемцитабин
хорошо переносился у пациентов старше 65 лет. Нет данных о том, что для пожилых
пациентов необходима коррекция дозы, помимо той, что рекомендована для всех
пациентов.
Пациенты с нарушением функции печени и почек
Применять
гемцитабин у пациентов с печеночной недостаточностью или с нарушенной
функцией почек следует с осторожностью, так как полученных в ходе клинических
исследований данных недостаточно для предоставления четких рекомендаций
относительно коррекции дозы у данных популяций пациентов.
Дети (младше 18 лет)
Гемцитабин
не рекомендуется для применения у детей младше 18 лет, поскольку данные
о безопасности и эффективности применения гемцитабина у детей ограничены.
Рекомендации по приготовлению раствора для инфузий
В
качестве растворителя используется только 0,9% раствор натрия хлорида без консервантов.
Для
приготовления раствора содержимое флакона 200 мг растворяют не менее, чем
5 мл, и 1 г — в не менее, чем 25 мл
0,9% раствора натрия хлорида для инъекций. Каждый флакон аккуратно
взбалтывают до полного растворения лиофилизата. Полученный раствор должен быть
прозрачным.
Максимальная
концентрация гемцитабина не должна превышать 40 мг/мл. Растворы,
приготовленные с концентрацией выше, чем 40 мг/мл, могут
сопровождаться неполным растворением.
Приготовленный
концентрат гемцитабина, содержащий нужную дозу препарата, перед введением
разбавляют 0,9% раствором натрия хлорида для инъекций в количестве,
достаточном для 30‑минутной внутривенной инфузии.
Перед
парентеральным введением необходимо визуально контролировать приготовленный
раствор на наличие механических примесей и изменение цвета.
Побочные действия
Реклама: ООО «РЛС-Патент», ИНН 5044031277
Самыми
распространенными нежелательными реакциями, связанными с терапией гемцитабином,
являются тошнота со рвотой или без рвоты, повышенный уровень печеночных
трансаминаз (АСТ/АЛТ) и щелочной фосфатазы, отмечавшиеся приблизительно у 60%
пациентов; протеинурия и гематурия, отмечавшиеся примерно у 50% пациентов;
одышка, отмечавшаяся у 10–40% пациентов (с наибольшей частотой у больных
раком легкого); аллергическая кожная сыпь, наблюдавшаяся приблизительно у 25% пациентов
и связанная с зудом у 10% пациентов.
На
частоту и степень тяжести нежелательных реакций влияют доза, скорость инфузии и
интервалы между введениями препарата. К дозолимитирующим нежелательным реакциям
относятся снижение числа тромбоцитов, лейкоцитов и гранулоцитов.
Данные клинических исследований
Нежелательные
реакции, встречавшиеся чаще, чем в единичных случаях, перечислены в соответствии
со следующей градацией: очень часто
(≥10%); часто (≥1%, <10%); нечасто (≥0,1%, <1%); редко
(≥0,01%, <0,1%); очень редко (<0,01%); частота неизвестна (не может
быть определена на основании имеющихся данных).
Инфекции и инвазии
Часто — инфекции; частота неизвестна — сепсис.
Нарушения со стороны крови и лимфатической системы
Очень часто
— анемия, лейкопения (как правило, наблюдается угнетение функции костного мозга
легкой или средней степени тяжести, и в основном оказывает действие на число
гранулоцитов) и тромбоцитопения; часто
— фебрильная нейтропения; очень редко
— тромбоцитоз, тромботическая микроангиопатия.
Нарушения со стороны иммунной системы
Очень редко
— анафилактическая реакция.
Нарушения метаболизма и питания
Часто — анорексия.
Нарушения со стороны нервной системы
Часто — головная
боль, бессонница, сонливость; нечасто
— нарушение мозгового кровообращения; очень
редко — синдром обратимой задней энцефалопатии.
Нарушения со стороны сердца
Нечасто — сердечная
недостаточность, аритмия, преимущественно суправентрикулярная; редко — инфаркт миокарда.
Нарушения со стороны сосудов
Редко — снижение
артериального давления, клинические признаки периферического васкулита и
гангрены; очень редко — синдром
повышенной проницаемости капилляров.
Нарушения со стороны дыхательной системы, органов грудной
клетки и средостения
Очень часто
— одышка (как правило, легкой степени тяжести и проходящая без лечения); часто — кашель, ринит; нечасто — бронхоспазм (как правило, легкой
степени тяжести и кратковременный, однако, может потребоваться проведение
парентеральной терапии), интерстициальный пневмонит; редко — отек легких, респираторный дистресс-синдром
взрослых.
Желудочно-кишечные нарушения
Очень часто
— тошнота, рвота; часто — диарея,
стоматит и язвенное поражение слизистой оболочки полости рта, запор; очень редко — ишемический колит.
Нарушения со стороны печени и желчевыводящих путей
Очень часто
— повышение концентрации «печеночных» трансаминаз (АСТ и АЛТ) и щелочной фосфатазы;
часто — повышение концентрации
билирубина; нечасто —
гепатотоксичность тяжелой степени, включая печеночную недостаточность, в некоторых
случаях с летальным исходом; редко —
повышение концентрации гамма-глутамилтрансферазы (ГГТ).
Нарушения со стороны кожи и подкожных тканей
Очень часто
— аллергические кожные высыпания, сопровождающиеся зудом, алопеция; часто — зуд, потливость; редко — язвы, образование везикул и
нарывов, шелушение, кожные реакции тяжелой степени, включая десквамацию и
буллезное поражение кожи; очень редко
— токсический эпидермальный некролиз, синдром Стивенса-Джонсона; частота неизвестна — псевдоцеллюлит.
Нарушения мышечной, скелетной и соединительной ткани
Часто — боль в спине,
миалгия.
Нарушения со стороны почек и мочевыводящих путей
Очень часто
— протеинурия легкой степени и гематурия; нечасто
— почечная недостаточность, гемолитико-уремический синдром.
Общие нарушения и реакции в месте введения
Очень часто
— гриппоподобные симптомы (наиболее частыми симптомами были лихорадка, головная
боль, озноб, миалгия, астения и анорексия; также сообщалось о случаях
развития кашля, ринита, недомогания, потоотделения и проблем со сном),
отек/периферический отек, в том числе отек лица (как правило, после
прекращения терапии наблюдалось разрешение отека); часто — лихорадка, астения, озноб; редко — реакции в месте введения (как
правило, легкой степени).
Травмы, интоксикации и осложнения процедур
Редко — лучевая
токсичность, повторное возникновение лучевых ожогов.
Применений гемцитабина в комбинации с паклитакселом при раке
молочной железы
Частота
гематологической токсичности 3 и 4 степени тяжести, в частности нейтропении,
увеличивается, когда гемцитабин применяется в комбинации с паклитакселом.
Однако увеличение частоты данных нежелательных реакций не связано с увеличением
частоты инфекций или геморрагических проявлений. Утомляемость и фебрильная
нейтропения возникают чаще, когда гемцитабин применяется в комбинации с паклитакселом.
Утомляемость, не связанная с анемией, обычно проходит после первого цикла.
Нежелательные явления 3 степени тяжести
Гематологическая
токсичность:
анемия
— 5,7%, тромбоцитопения — 5,3%, нейтропения — 31,3%.
Негематологическая
токсичность:
фебрильная
нейтропения — 4,6%, повышенная утомляемость — 5,7%, диарея — 3,1%, моторная
нейропатия — 2,3%, сенсорная нейропатия — 5,3%.
Нежелательные явления 4 степени тяжести
Гематологическая
токсичность:
анемия
— 1,1%, тромбоцитопения — 0,4%, нейтропения — 17,2% (нейтропения 4 степени
длительностью более 7 дней была зарегистрирована у 12,6% пациентов).
Негематологическая
токсичность:
фебрильная
нейтропения — 0,4%, повышенная утомляемость — 0,8%, моторная нейропатия — 0,4%,
сенсорная нейропатия — 0,4%.
Применение гемцитабина в комбинации с цисплатином при раке
мочевого пузыря
Нежелательные явления 3 степени тяжести
Гематологическая
токсичность:
анемия
— 24%, тромбоцитопения — 29%.
Негематологическая
токсичность:
тошнота
и рвота — 22%, диарея — 3%, инфекция — 2%, стоматит — 1%.
Нежелательные явления 4 степени тяжести
Гематологическая
токсичность:
анемия
— 4%, тромбоцитопения — 29%.
Негематологическая
токсичность:
инфекция
— 1%.
Применение гемцитабина в комбинации с карбоплатином при раке
яичников
Нежелательные явления 3 степени тяжести
Гематологическая
токсичность:
анемия
— 22,3%, нейтропения — 41,7%, тромбоцитопения — 30,3%, лейкопения — 48%.
Негематологическая
токсичность:
кровотечение
— 1,8%, фебрильная нейтропения — 1,1%.
Нежелательные явления 4 степени тяжести
Гематологическая
токсичность:
анемия
— 5,1%, нейтропения — 28,6%, тромбоцитопения — 4,6%, лейкопения — 5,1%.
Негематологическая
токсичность:
инфекция
без нейтропении — 0,6%.
Взаимодействие
Лучевая терапия
Сопутствующая
(одновременно или с интервалом ≤7 дней) — токсичность, связанная
с мультимодальной терапией зависит от следующих факторов: доза
гемцитабина, частота назначения гемцитабина, доза радиации, техника
планирования лучевой терапии, орган-мишень и целевой объем облучения. В
доклинических и клинических исследованиях показано, что гемцитабин обладает
радиосенсибилизирующим действием. В клиническом исследовании, где
гемцитабин назначался в течение 6 недель подряд одновременно с лучевой
терапией грудной клетки пациентам с НМРЛ, была показана токсичность,
проявляющаяся в виде острых, потенциально опасных для жизни мукозитов,
в частности, эзофагит и пневмония, особенно у пациентов с большим объемом
облучения (средний объем 4795 см3). В последующих исследованиях
НМРЛ было установлено, что гемцитабин в меньших дозах может применяться
совместно с лучевой терапией. Облучение грудной клетки в дозе 66 Грей
проводилось совместно с назначением гемцитабина (600 мг/м2
4 раза) и цисплатином (80 мг/м2 дважды) в течение 6
недель. На сегодня не подобран оптимальный режим гемцитабина для безопасного
совместного применения с терапевтическими дозами лучевой терапии для всех видов
опухоли.
Раздельная
(интервал >7 дней) — не установлено повышенной токсичности при назначении
гемцитабина с интервалом более 7 дней до или после лучевой терапии, кроме
самого эффекта от облучения. Применение гемцитабина можно начинать после
исчезновения острых нежелательных реакций от лучевой терапии или, как минимум
спустя неделю после лучевой терапии.
Радиационное
повреждение органов-мишеней (например, эзофагиты, колиты и пневмония) имело
место как при сопутствующем применении гемцитабина, так и при раздельной
лучевой терапии.
Другие
Пациентам,
получающим лечение гемцитабином, не рекомендуется вакцинация против желтой
лихорадки или введение других живых ослабленных вакцин по причине риска
системных, с вероятностью летального исхода, заболеваний (особенно у иммуносупрессивных
пациентов).
Передозировка
Антидот
гемцитабина отсутствует. При внутривенном введении в течение 30 минут доз,
превышающих 5700 мг/м2 каждые две недели, проявлялась
клинически допустимая токсичность. В случае подозреваемой передозировки
пациент должен находиться под постоянным врачебным контролем, включающим
подсчет формулы крови. При необходимости проводится поддерживающая
терапия.
Особые указания
Увеличение
продолжительности инфузии, и повышенная частота введения препарата могут
привести к повышению токсичности.
Гематологическая токсичность
Гемцитабин
может подавлять функцию костного мозга, что проявляется лейкопенией,
тромбоцитопенией или анемией. Перед каждым введением гемцитабина необходимо
контролировать количество тромбоцитов, лейкоцитов и гранулоцитов в крови
у пациентов, получающих терапию препаратом Гемцитабин. При признаках
угнетения функции костного мозга, вызванного препаратом, необходимо
приостановить лечение или скорректировать дозу. Миелосупрессия кратковременна,
как правило, не приводит к уменьшению дозы и редко приводит к отмене
терапии.
Число
клеток периферической крови может продолжать уменьшаться после прекращения
применения гемцитабина. У пациентов с нарушением функции костного мозга терапию
следует начинать с осторожностью. При одновременном применении гемцитабина
с другой химиотерапией, как и при применении других видов
цитотоксической терапии, необходимо учитывать риск кумулятивной супрессии
функции костного мозга.
Нарушение функции почек и печени
Следует
с осторожностью применять гемцитабин у пациентов с нарушением функции
печени или почек, так как полученных в ходе клинических исследований данных
недостаточно для предоставления четких рекомендаций относительно коррекции дозы
у данной популяции пациентов.
Введение
гемцитабина при метастазах в печени, при гепатите и алкоголизме в анамнезе,
а также при циррозе печени увеличивает риск развития печеночной
недостаточности.
Необходимо
регулярно проводить лабораторные исследования для оценки функции почек и
печени.
Сопутствующая лучевая терапия
Сопутствующая
лучевая терапия (проводимая одновременно или с разницей в ≤7 дней):
наблюдались случаи развития токсичности.
Живые вакцины
Вакцину
против желтой лихорадки и другие живые аттенуированные вакцины
не рекомендуется применять у пациентов, получающих терапию гемцитабином.
Синдром обратимой задней энцефалопатии
У
пациентов, получавших гемцитабин в качестве монотерапии или в комбинации
с другими химиотерапевтическими препаратами, отмечались случаи развития
синдрома обратимой задней энцефалопатии с потенциально тяжелыми последствиями.
У большинства пациентов с синдромом обратимой задней энцефалопатии
наблюдались острая артериальная гипертензия и судорожная активность, но могли
присутствовать и другие симптомы, например, головная боль, вялость, спутанность
сознания и слепота. Диагноз подтверждается посредством проведения
магнитно-резонансной томографии. Синдром обратимой задней энцефалопатии обычно
был обратимым при применении соответствующих поддерживающих мер. Если в
ходе лечения развивается синдром обратимой задней энцефалопатии, применение
гемцитабина следует окончательно прекратить и принять поддерживающие меры, в
том числе контроль артериального давления и противосудорожную терапию.
Сердечно-сосудистая система
Из‑за
риска нарушений со стороны сердца и (или) сосудов при применении гемцитабина
особую осторожность следует проявлять при лечении пациентов с
сердечно-сосудистыми явлениями в анамнезе.
Синдром
повышенной проницаемости капилляров
Синдром
повышенной проницаемости капилляров наблюдался у пациентов, получавших
гемцитабин в монотерапии или в комбинации с другими химиотерапевтическими
препаратами. Данное состояние обычно поддается лечению в случае распознавания
на ранней стадии и проведения соответствующего лечения, но отмечались и
летальные исходы. Состояние заключается в системном повышении проницаемости
капилляров, при котором жидкости и белки из внутрисосудистого пространства
проникают в интерстиций. Клинические признаки включают генерализованный
отек, повышение массы тела, гипоальбуминемию, тяжелую артериальную гипотензию,
острую почечную недостаточность и отек легкого. В случае развития синдрома
повышенной проницаемости капилляров в ходе терапии, применение гемцитабина
должно быть прекращено и приняты поддерживающие меры. Синдром повышенной
проницаемости капилляров может возникать в течение более поздних циклов, и в
литературе он ассоциируется с респираторным дистресс-синдромом взрослых.
Функция
легких
Кроме
респираторного дистресс-синдрома взрослых, другие нарушения функций легких,
иногда тяжелой степени (например, отек легких, интерстициальный пневмонит),
были зарегистрированы у пациентов, получавших гемцитабин. При развитии
таких нежелательных реакций следует рассмотреть вопрос о прекращении терапии
гемцитабином. Раннее использование симптоматической терапии может улучшить
ситуацию.
Почки
Гемолитико-уремический
синдром
У
пациентов, получавших гемцитабин, редко отмечались клинические изменения,
соответствующие гемолитико-уремическому синдрому (ГУС) (данные по периоду
пострегистрационного применения). ГУС является нарушением, представляющим потенциальную
угрозу для жизни. Необходимо прекратить терапию гемцитабином при первых
признаках любого свидетельства микроангиопатической гемолитической анемии,
таких как быстро снижающийся уровень гемоглобина с сопутствующей
тромбоцитопенией, повышение уровня билирубина сыворотки крови, креатинина
сыворотки крови, азота мочевины крови или ЛДГ. Почечная недостаточность
может быть необратимой при отмене терапии и может потребоваться диализ.
Фертильность
В
исследованиях фертильности гемцитабин вызывал гипосперматогенез у самцов мышей.
Поэтому мужчинам, получающим терапию гемцитабином, не рекомендуется отцовство
во время лечения и в течение 6 месяцев после его окончания. До начала
лечения следует обратиться за дополнительной консультацией в отношении
криоконсервации спермы из‑за возможного бесплодия вследствие терапии
гемцитабином.
Влияние на способность к управлению
транспортными средствами или потенциально опасными механизмами
Влияние
гемцитабина на способность к управлению транспортными средствами или
потенциально опасными механизмами не изучалось. Однако, исходя из данных о способности
гемцитабина вызывать небольшую сонливость (особенно при совместном приеме
алкоголя), пациенту следует воздержаться от управления транспортными
средствами или потенциально опасными механизмами на период лечения
гемцитабином.
Форма выпуска
Лиофилизат
для приготовления концентрата для приготовления раствора для инфузий
по 200 мг во флаконы стеклянные вместимостью 10 мл или по
1000 мг во флаконы стеклянные вместимостью 50 мл, укупоренные
пробками резиновыми (типа V9154 или типа 3 исполнения 1) и обкатанные
колпачками алюминиевыми или комбинированными или алюмопластиковыми или
алюминиевыми с пластиковой накладкой. Каждый флакон вместе с инструкцией
по применению помещают в пачку из картона.
Упаковка
для стационаров: по 40 флаконов — для дозировки 200 мг и по 15 или
20 флаконов — для дозировки 1000 мг с равным количеством
инструкций по применению помещают в групповую тару.
Условия отпуска из аптек
Условия хранения
Хранить
в защищенном от света месте при температуре не выше 25 °С.
Хранить
в недоступном для детей месте.
Срок годности
2 года.
Не
применять после истечения срока годности.
Производитель
РУП
«Белмедпрепараты», Республика Беларусь.
Юридический адрес и адрес для принятия претензий:
220007,
г. Минск, ул. Фабрициуса, 30.
Тел./факс:
(+375 17) 220-37-16.
E—mail:
medic@belmedpreparaty.com
Адрес места производства:
Республика
Беларусь, 220007, г. Минск, ул. Фабрициуса, 30.
Описание проверено
-
Комкова Людмила Александровна
(Провизор)
Опыт работы: более 12 лет
Гемцитабин (Фармэра) — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер
ЛП-006096
Торговое наименование препарата
Гемцитабин
Международное непатентованное наименование
Гемцитабин
Лекарственная форма
концентрат для приготовления раствора для инфузий
Состав
Состав на 1 мл:
действующее вещество: гемцитабина гидрохлорид 45,540 мг, в пересчете на гемцитабин 40,00 мг;
вспомогательные вещества: натрия ацетата тригидрат 4,148 мг, натрия гидроксид (0,1 М раствор) до pH 2,7-3,3, хлористоводородная кислота (0,1 М раствор) до pH 2,7-3,3, вода для инъекций до 1 мл.
Описание
Прозрачный раствор от бесцветного до коричневато-желтого или светло-желтого цвета.
Фармакотерапевтическая группа
Противоопухолевое средство, антиметаболит
Код АТХ
L01BC05
Фармакодинамика:
Противоопухолевое средство, антиметаболит группы аналогов пиримидина, подавляет синтез ДНК. Проявляет циклоспецифичность, действуя на клетки в фазах S и G1/S. Метаболизируется в клетке под действием нуклеозидкиназ до активных дифосфатных и трифосфатных нуклеозидов. Дифосфатные нуклеозиды ингибируют действие рибонуклеотидредукгазы (единственного фермента, катализирующего образование дезоксинуклеозидтрифосфатов, необходимых для синтеза ДНК). Трифосфатные нуклеозиды способны встраиваться в цепь ДНК (в меньшей степени РНК), что приводит к прекращению дальнейшего синтеза ДНК и запрограммированной гибели клетки (апоптоз). При раке поджелудочной железы считается препаратом I линии: монотерапия вызывает у 25-40 % пациентов клиническое улучшение, а у 10-15 % пациентов — частичную ремиссию продолжительностью 11-12 недель; 23 % пациентов живут более года. При сочетании гемцитабина с цисплатином эффективность лечения увеличивается до 69 %. Гемцитабин является также сильным радиосенсибилизирующим средством даже в концентрациях более низких, чем цитотоксические.
Фармакокинетика:
При внутривенном введении гемцитабина от 0,5 г/м2 до 2,5 г/м2 в течение 0,4-1,2 ч максимальная плазменная концентрация (Сmах) препарата достигается через 5 мин после окончания инфузии и составляет от 3,2 мкг/мл до 45,5 мкг/мл.
Объем распределения в существенной мере зависит от продолжительности инфузии и пола: в среднем 12,4 л/м2 у женщин и 17,5 л/м2 для мужчин. Связывание с белками плазмы крови низкое и составляет менее 10 %.
В организме гемцитабин быстро метаболизируется под действием цитидиндезаминазы в печени, почках, крови и других тканях, в результате чего образуются гемцитабин моно-, ди- и трифосфаты, из которых активными считаются ди- и трифосфаты гемцитабина. Внутриклеточные метаболиты гемцитабина не обнаруживаются в плазме крови или моче. Основной метаболит гемцитабина — 2′-дезокси-2′,2′-дифторуридин, не является активным и его концентрации определяются в плазме крови и моче. Период полувыведения варьирует от 42 до 94 мин в зависимости от возраста и пола пациента. При соблюдении рекомендованного режима дозирования полное выведение гемцитабина происходит в течение 5-11 ч от начала инфузии. При введении один раз в неделю гемцитабин не накапливается в организме.
Системный клиренс гемцитабина варьирует от 29,2 л/ч/м2 до 92,2 л/ч/м2, в зависимости от пола и возраста пациента. Клиренс гемцитабина у женщин приблизительно на 25 % ниже, чем у мужчин. Клиренс гемцитабина уменьшается с возрастом. При введении гемцитабина в рекомендованной дозе 1000 мг/м2 за 30 мин наименьшее значение клиренса у женщин и мужчин не требует снижения дозы препарата.
Менее 10 % введенной дозы гемцитабина выводится почками в неизменном виде. Почечный клиренс варьирует от 2 л/ч/м2 до 7 л/ч/м2. В течение недели после введения гемцитабина от 92 % до 98 % дозы выводится из организма: 99 % почками, главным образом в форме 2′-дезокси-2′,2′-дифторуридина, остальное выводится кишечником.
Кинетика трифосфата гемцитабина
Данный метаболит обнаруживается в мононуклеарных клетках периферической крови. Внутриклеточная концентрация трифосфата гемцитабина пропорционально возрастает при увеличении дозы гемцитабина от 35 мг/м2 до 350 мг/м2 при внутривенном введении в течение 30 мин, что позволяет достичь плазменной концентрации препарата 0,45 мкг/мл. При плазменной концентрации гемцитабина более 5 мкг/мл концентрация трифосфата гемцитабина не увеличивается. Период полувыведения (Т1/2) составляет 1,7-19,4 ч.
При комбинированной терапии гемцитабина и паклитаксела не отмечено изменений в фармакокинетике препаратов.
При комбинированной терапии гемцитабина и карбоплатина не отмечено изменений в фармакокинетике препаратов.
Почечная недостаточность легкой или средней степени тяжести (скорость клубочковой фильтрации 30-80 мл/мин) не оказывает существенного влияния на фармакокинетику гемцитабина.
Показания:
— Местнораспространенный или метастатический немелкоклеточный рак легкого в качестве терапии первой линии в комбинации с цисплатином или карбоплатином, а также в монотерапии у пожилых пациентов с функциональным статусом, равным 2;
— нерезектабельный, местнорецидивирующий или метастатический рак молочной железы в составе комбинированной терапии с паклитакселом после проведения неоадъювантной и/или адъювантной терапии с включением антрациклинов при отсутствии противопоказаний к их назначению;
— местнораспространенный или метастатический уротелиальный рак (рак мочевого пузыря, почечной лоханки, мочеточника, мочеиспускательного канала);
— местнораспространенный или метастатический эпителиальный рак яичников в качестве монотерапии или в сочетании с карбоплатином у пациентов с прогрессированием заболевания после проведения первой линии терапии на основе производных платины;
— местнораспространенный или метастатический рак поджелудочной железы;
— местнораспространенный или метастатический рак шейки матки;
— рак желчевыводящих путей.
Показана эффективность гемцитабина при распространенном мелкоклеточном раке легкого и распространенном рефрактерном раке яичка.
Противопоказания:
— Гиперчувствительность к гемцитабину или к любому другому компоненту препарата;
— беременность и период грудного вскармливания;
— детский возраст до 18 лет (эффективность и безопасность препарата не установлена).
С осторожностью:
С осторожностью следует применять препарат у пациентов с нарушенной функцией печени (при метастатическом поражении печени, гепатите, алкоголизме) и/или почек, у пациентов с угнетением костномозгового кроветворения (в т.ч. на фоне сопутствующей лучевой или химиотерапии), острыми инфекционными заболеваниями вирусной, грибковой или бактериальной природы (в т.ч. при ветряной оспе, опоясывающем лишае), сердечно-сосудистыми заболеваниями (в т.ч. в анамнезе), при одновременно проводимой лучевой терапии.
Беременность и лактация:
Адекватных и контролируемых исследований по применению гемцитабина у беременных и кормящих женщин не проводилось. Однако в исследованиях на животных препарат оказывает тератогенные, эмбрио- и фетотоксичные эффекты, поэтому применение гемцитабина противопоказано при беременности.
Неизвестно, проникает ли гемцитабин в грудное молоко, поэтому при применении в период лактации необходимо отказаться от грудного вскармливания младенца.
Способ применения и дозы:
Гемцитабин вводится внутривенно капельно в течение 30 мин.
Перед каждым введением гемцитабина необходимо контролировать количество тромбоцитов, лейкоцитов и гранулоцитов в крови. При признаках угнетения функции костного мозга, вызванного препаратом, необходимо приостановить лечение или скорректировать дозу.
Немелкоклеточный рак легкого (местнораспространенный или метастатический), первая линия терапии
Монотерапия: рекомендованная доза препарата — 1000 мг/м2 в 1, 8 и 15 дни каждого 28-дневного цикла.
Комбинированная терапия с цисплатином: рекомендованная доза препарата — 1250 мг/м2 в 1 и 8 день каждого 21-дневного цикла или 1000 мг/м2 в 1, 8 и 15 дни каждого 28-дневного цикла. Цисплатин вводится в дозе 70 мг/м2 в 1 день цикла после инфузии гемцитабина на фоне гипергидратации.
Комбинированная терапия с карбоплатином: рекомендованная доза препарата — 1000 мг/м2 или 1200 мг/м2 в 1 и 8 день каждого 21-дневного цикла. Карбоплатин вводится из расчета AUC (площадь под кривой «концентрация-время») 5,0 мг/мл/мин в 1 день цикла после инфузии гемцитабина.
Рак молочной железы (нерезектабельный, местнорецидивирующий или метастатический)
Комбинированная терапия с паклитакселом: в качестве терапии первой линии при прогрессировании заболевания после неоадъювантной и/или адъювантной терапии, включающей антрациклины, при отсутствии противопоказаний к ним.
Паклитаксел вводится в дозе 175 мг/м2 внутривенно капельно в течение 3 ч в 1 день 21-дневного цикла с последующим введением гемцитабина. Рекомендованная доза препарата — 1250 мг/м2 в 1 и 8 день каждого 21-дневного цикла.
Перед началом комбинированной терапии (гемцитабинпаклитаксел) абсолютное число гранулоцитов в крови у пациента должно быть не менее 1500/мкл.
Уротелиальный рак (рак мочевого пузыря (местнораспространенный, метастатический и поверхностный), почечной лоханки, мочеточника, мочеиспускательного канала)
Монотерапия: рекомендованная доза препарата — 1250 мг/м2 в 1, 8 и 15 дни каждого 28-дневного цикла.
Комбинированная терапия с нистатином: рекомендованная доза препарата — 1000 мг/м2 в 1, 8 и 15 дни в сочетании с цисплатином, который вводится в дозе 70 мг/м2 сразу после инфузии гемцитабина в 1 или во 2 день каждого 28-дневного цикла. Клинические исследования показали, что при дозе цисплатина 100 мг/м2 наблюдается более выраженная миелосупрессия.
Эпителиальный рак яичников (местнораспространенный или метастатический, резистентный к производным платины)
Монотерапия: рекомендованная доза препарата — 800-1250 мг/м2 в 1, 8 и 15 дни каждого 28-дневного цикла.
Комбинированная терапия с карбоплатином: рекомендованная доза препарата — 1000 мг/м2 в 1 и 8 день в сочетании с карбоплатином из расчета AUC 4,0 мг/мл/мин, который вводится сразу после инфузии гемцитабина в 1 день каждого 21-дневного цикла.
Рак поджелудочной железы (местнораспространенный или метастатический, в т.ч. резистентный к терапии фторурацилом)
Монотерапия: рекомендованная доза препарата — 1000 мг/м2 один раз в неделю в течение 7 недель с последующим недельным перерывом. Затем препарат вводится в 1, 8 и 15 дни каждого 28-дневного цикла.
Рак шейки матки (местнораспространенный или метастатический)
Комбинированная терапия с цисплатином: при местнораспространенном раке при последовательной химиолучевой терапии (неоадъюватно) и при метастатическом раке цисплатин вводится в дозе 70 мг/м2 в 1 день цикла на фоне гипергидратации с последующим введением гемцитабина.
Гемцитабин вводится в дозе 1250 мг/м2 в 1 и 8 день каждого 21-дневного цикла.
При местнораспространенном раке при одновременной химиолучевой терапии цисплатин вводится в дозе 40 мг/м2 с последующим (непосредственно после введения цисплатина) введением гемцитабина. Гемцитабин вводится 1 раз в неделю за 1 -2 ч до начала лучевой терапии в дозе 1250 мг/м2.
Рак желчевыводящих путей
Комбинированная терапия с нистатином: цисплатин вводится в дозе 70 мг/м2 в 1 день цикла на фоне гипергидратации с последующим введением гемцитабина. Гемцитабин вводится в дозе 1250 мг/м2 в 1 и 8 день каждого 21-дневного цикла.
Коррекция дозы
В случае развития гематологической токсичности доза гемцитабина может быть уменьшена, либо его введение отложено в соответствии со следующими схемами:
А. Коррекция дозы гемцитабина в рамках цикла при уротелиальном раке, немелкоклеточном раке легкого, раке поджелудочной железы в качестве монотерапии или в комбинации с цисплатином
|
Абсолютное количество гранулоцитов (в 1 мкл) |
Количество тромбоцитов (в 1 мкл) |
% от предыдущей дозы |
|
|
>1000 |
и |
>100000 |
100 |
|
500 — 1000 |
или |
50000 -100000 |
75 |
|
<500 |
или |
<50000 |
Отложить введение |
Б. Коррекция дозы гемцитабина в рамках цикла при раке молочной железы в комбинации с паклитакселом
|
Абсолютное количество гранулоцитов (в 1 мкл) |
Количество тромбоцитов (в 1 мкл) |
% от предыдущей дозы |
|
|
>1200 |
и |
>75000 |
100 |
|
1000-<1200 |
или |
50000 — 75000 |
75 |
|
700-<1000 |
и |
≥50000 |
50 |
|
<700 |
или |
<50000 |
Отложить введение |
В. Коррекция дозы гемцитабина в рамках цикла при раке яичников в комбинации с карбоплатином
|
Абсолютное количество гранулоцитов (в 1 мкл) |
Количество тромбоцитов (в 1 мкл) |
% от предыдущей дозы |
|
|
>1500 |
и |
≥100000 |
100 |
|
1000 — 1500 |
или |
75000 — 100000 |
50 |
|
<1000 |
или |
<75000 |
Отложить введение |
Для выявления негематологической токсичности необходимо проводить регулярное обследование пациента и контролировать функцию печени и почек. В зависимости от степени токсичности дозу можно снижать в ходе каждого цикла или с началом нового ступенчато.
Введение препарата должно быть отложено до тех пор, пока, по мнению врача, токсичность не разрешится.
Особые группы пациентов
Пациенты с нарушениями функции печени или почек
Применять гемцитабин у пациентов с печеночной недостаточностью или с нарушенной функцией почек следует с осторожностью, так как достаточных данных по применению препарата у этой категории пациентов нет.
Почечная недостаточность легкой или средней степени тяжести (скорость клубочковой фильтрации от 30 мл/мин до 80 мл/мин) не оказывает заметного влияния на фармакокинетику гемцитабина.
Дети
Гемцитабин изучался в ограниченных исследованиях I и II фазы у детей с различными типами новообразований. Данных этих исследований недостаточно для доказательства эффективности и безопасности применения гемцитабина у детей.
Пожилые пациенты (старше 65 лет)
Нет данных, позволяющих предположить, что у пожилых пациентов необходимо корректировать дозу.
Правила приготовления раствора для инфузий
В качества растворителя используется 0,9 % раствор натрия хлорида (без консервантов) или 5% раствор декстрозы.
1. Для приготовления раствора необходимо придерживаться требований приготовления растворов для в/в введения.
2. Переносят необходимый объем концентрата в асептических условиях в пригодный инфузионный мешок или флакон.
3. Тщательно перемешать.
4. Полученный раствор должен быть прозрачным, от бесцветного до бледно-желтого цвета.
5. Перед парентеральным введением необходимо визуально контролировать приготовленный раствор на наличие механических примесей и изменения цвета. Запрещается вводить раствор, если в нем обнаружены частицы.
6. Любой неиспользованный препарат или отходы должны быть утилизированы в соответствии с локальными требованиями.
С микробиологической точки зрения рекомендуется использовать препарат немедленно после вскрытия или разведения. В противном случае время и условия хранения контролируются ответственным лицом, но при вскрытии и разведении в асептических условиях флакон после вскрытия и разведенный раствор для инфузий хранить в защищенном от света месте при температуре от 2 до 8 °С не более 24 ч.
Побочные эффекты:
По данным Всемирной организации здравоохранения (ВОЗ) нежелательные реакции классифицированы в соответствии с их частотой развития следующим образом: очень часто (≥1/10), часто (от ≥1/100 до <1/10), нечасто (от ≥1/1000 до <1/100), редко (от ≥1/10000 до <1/1000), очень редко (<1 /10000); частота неизвестна — по имеющимся данным установить частоту возникновения не представлялось возможным.
Инфекции и инвазии:
часто: инфекционные заболевания;
частота неизвестна: сепсис.
Нарушения со стороны системы крови и лимфатической системы:
очень часто: лейкопения (миелосупрессия обычно имеет легкую или умеренную степень и проявляется главным образом изменением количества гранулоцитов), тромбоцитопения, анемия;
часто: фебрильная нейтропения;
очень редко: тромбоцитоз, тромботическая микроангиопатия.
Нарушения со стороны иммунной системы:
очень редко: анафилактоидная реакция.
Нарушения со стороны нервной системы:
часто: головная боль, бессонница, сонливость;
очень редко: синдром обратимой задней энцефалопатии (СОЗЭ).
Нарушения со стороны сердца:
нечасто: сердечная недостаточность (в т.ч. прогрессирование имеющейся сердечной недостаточности), аритмия, преимущественно суправентрикулярная;
редко: инфаркт миокарда;
Нарушения со стороны сосудов:
нечасто: нарушение мозгового кровообращения;
редко: периферический васкулит (иногда возможно развитие гангрены), снижение артериального давления;
очень редко: синдром повышенной проницаемости капилляров.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения:
очень часто: одышка — как правило, легкой степени, быстро исчезающая без лечения;
часто: кашель, ринит;
нечасто: интерстициальный пневмонит, бронхоспазм — как правило, легкой степени и носит преходящий характер, но может потребовать парентерального лечения;
редко: острый респираторный дистресс-синдром, отек легких.
Нарушения со стороны желудочно-кишечного тракта:
очень часто: тошнота, рвота;
часто: диарея, стоматит и язвы слизистой оболочки полости рта, запор; очень редко: ишемический колит.
Нарушения со стороны печени и желчевыводящих путей:
очень часто: повышение активности «печеночных» трансаминаз и щелочной фосфатазы;
часто: повышение концентрации билирубина;
нечасто: гепатотоксичность тяжелой степени, включая печеночную недостаточность и смерть;
редко: повышение активности гамма-глутамилтрансферазы.
Нарушения со стороны колеи и подкожных тканей:
очень часто: кожная аллергическая сыпь, часто сопровождаемая зудом, алопеция;
часто: зуд, повышенное потоотделение;
редко: реакции со стороны кожи тяжелой степени, включая десквамацию и буллезные высыпания, изъязвления, образование пузырей и язв, шелушение кожи;
очень редко: токсический эпидермальный некролиз, синдром Стивенса-Джонсона;
частота неизвестна: псевдоцеллюлит.
Нарушения со стороны почек и мочевыводящих путей:
очень часто: гематурия, протеинурия легкой степени;
нечасто: почечная недостаточность, гемолитический уремический синдром.
Нарушения со стороны скелетно-мышечной и соединительной ткани:
часто: боль в спине, миалгия.
Прочие:
очень часто: гриппоподобный синдром (наиболее частыми симптомами являются повышение температуры тела, головная боль, астения, озноб, миалгия, анорексия; сообщалось о кашле, рините, недомогании, потоотделении), периферические отеки, в том числе отек лица, обычно обратимые после прекращения лечения;
часто: повышение температуры тела, астения, озноб, анорексия;
редко: реакции в месте введения, токсичность лучевой терапии, реактивация лучевых ожогов.
Применение гемцитабина в комбинации с паклитакселом при раке молочной железы
|
Нежелательные явления III и IV степени тяжести |
||
|
Количество (%) пациентов. Общее число — 262 |
||
|
III степень |
IV степень |
|
|
Гематологическая токсичность |
||
|
Анемия |
15(5,7) |
3(1,1) |
|
Тромбоцитопения |
14(5,3) |
1 (0,4) |
|
Нейтропения |
82 (31,3) |
45(17,2)* |
|
Негематологическая токсичность |
||
|
Фебрильная нейтропения |
12(4,6) |
1 (0,4) |
|
Утомляемость |
15(5,7) |
2 (0,8) |
|
Диарея |
8(3,1) |
0 |
|
Двигательная нейропатия |
6 (2,3) |
1 (0,4) |
|
Сенсорная нейропатия |
14(5,3) |
1 (0,4) |
*Нейтропению 4 степени продолжительностью более 7 дней наблюдали у 12,6 % пациентов в группе комбинированного лечения и у 5,0 % пациентов в группе лечения паклитакселом.
Применение гемцитабина в комбинации с цисплатином при раке мочевого пузыря
|
Нежелательные явления III и IV степени тяжести |
||
|
Количество (%) пациентов. Общее число — 200 |
||
|
III степень |
IV степень |
|
|
Гематологическая токсичность |
||
|
Анемия |
47 (24) |
7(4) |
|
Тромбоцитопения |
57 (29) |
57 (29) |
|
Негематологическая токсичность |
||
|
Тошнота и рвота |
44 (22) |
0(0) |
|
Диарея |
6(3) |
0(0) |
|
Инфекции |
4(2) |
1(1) |
|
Стоматит |
2(1) |
0(0) |
Применение гемцитабина в комбинации с карбоплатином при раке яичников
|
Нежелательные явления III и IV степени тяжести |
||
|
Количество (%) пациентов. Общее число — 175 |
||
|
III степень |
IV степень |
|
|
Гематологическая токсичность |
||
|
Анемия |
39 (22,3) |
9(5,1) |
|
Тромбоцитопения |
53 (30,3) |
В (4,6) |
|
Нейтропения |
73 (41,7) |
50 (28,6) |
|
Лейкопения |
84 (48,0) |
9(5,1) |
|
Негематологическая токсичность |
||
|
Кровотечение |
3(1,8) |
0(0) |
|
Фебрильная нейтропения |
2(1,1) |
0(0) |
|
Инфекция без нейтропении |
0(0) |
1 (0,6) |
В группе комбинированного лечения частота сенсорной нейропатии также была выше, чем в группе монотерапии карбоплатином.
Передозировка:
Симптомы: миелосупрессия, парестезии, выраженная кожная сыпь. При внутривенных инфузиях препарата в дозах до 5700 мг/м2, выполнявшихся в течение 30 минут каждые 2 недели, уровень токсичности был клинически приемлемым.
Лечение: специфического антидота нет. При подозрении на передозировку пациент должен находиться под постоянным врачебным контролем, включающим подсчет формулы крови; при необходимости проводится симптоматическое лечение.
Взаимодействие:
Исследований по взаимодействию гемцитабина с другими лекарственными препаратами не проводилось.
Доклинические и клинические исследования показали, что гемцитабин обладает радиосенсибилизирующим действием. В единичном исследовании, в котором гемцитабин в дозе 1000 мг/м2 в течение 6 последовательных недель применялся одновременно с терапевтическим облучением грудной клетки у пациентов с немелкоклеточным раком легких, была зафиксирована значительная токсичность в форме тяжелого и потенциально опасного для жизни воспаления слизистых оболочек (мукозита), главным образом эзофагита и пневмонита, в особенности у пациентов, получающих большие объемы лучевой терапии [медианные объемы лечения — 4795 см3]. Проведенные впоследствии исследования (исследование фазы II при немелкоклеточном раке легких) свидетельствуют о возможности применения гемцитабина в более низких дозах совместно с лучевой терапией с предсказуемой токсичностью. Лучевая терапия на область грудной клетки в 66 Гр проводилась одновременно с терапией гемцитабином (доза 600 мг/м2, 4 введения) и цисплатином (доза 80 мг/м2 введения) в течение 6 недель. Оптимальный режим безопасного применения гемцитабина совместно с терапевтическими дозами облучения при всех типах опухолей еще не был определен. Введение гемцитабина более чем за 7 дней до начала лучевой терапии или более чем через 7 дней после ее завершения не сопровождается повышением токсичности.
Снижает выработку антител и усиливает побочные эффекты при одновременном применении инактивированных или живых вирусных вакцин (интервал между применением вакцин должен быть от 3 до 12 месяцев).
Частота явлений гематологической токсичности 3 и 4 степени, особенно нейтропении, возрастает при совместном применении гемцитабина и паклитаксела. Однако увеличение частоты этих побочных действий не связано с увеличением частоты инфекций или случаев кровотечения. Повышенная утомляемость и фебрильная нейтропения встречаются чаще при применении гемцитабина в комбинации с паклитакселом. Повышенная утомляемость, не связанная с анемией, обычно исчезает после первого цикла терапии.
Особые указания:
Лечение гемцитабином можно проводить только под наблюдением врача, имеющего опыт применения противоопухолевой химиотерапии. Гемцитабин может применяться как в виде монотерапии, так и в сочетании с другими противоопухолевыми препаратами. Доза и схема применения препарата подбирается индивидуально. Принимая во внимание риск развития тяжелых токсических реакций, в том числе и с летальным исходом, врач обязан подробно проинформировать пациента о возможном риске и необходимых мерах безопасности. Начинать лечение необходимо в условиях стационара.
Перед каждым введением гемцитабина необходимо контролировать клинический анализ крови с количественным подсчетом форменных элементов крови (тромбоцитов, лейкоцитов, нейтрофилов). При угнетении функции костного мозга необходимо приостановить лечение или скорректировать дозу гемцитабина. Увеличение длительности и частоты инфузии приводит к возрастанию токсичности гемцитабина.
Препарат следует с осторожностью назначать пациентам с нарушениями функции костного мозга. Для гемцитабина, как и для других цитотоксических препаратов, характерен риск кумулятивной миелосупрессии на фоне комбинированной химиотерапии. Применение гемцитабина у пациентов с метастазами в печень или с гепатитом, алкоголизмом или циррозом печени в анамнезе может способствовать ухудшению сопутствующей печеночной недостаточности.
Гемцитабин следует с осторожностью назначать пациентам с печеночной недостаточностью или с нарушениями функции почек, так как на сегодняшний день информации, полученной в ходе клинических исследований, недостаточно для четких рекомендаций по изменению дозы препарата у данных категорий пациентов.
Периодически необходимо осуществлять оценку лабораторных показателей функции почек и печени.
У пациентов, получающих гемцитабин, редко выявляют клинические симптомы гемолитико-уремического синдрома (ГУС). ГУС представляет собой состояние, представляющее потенциальную угрозу для жизни. Гемцитабин следует отменить при появлении первых симптомов, свидетельствующих о микроангиопатической гемолитической анемии, таких как быстрое снижение уровня гемоглобина с сопутствующей тромбоцитопенией, повышение в сыворотке крови билирубина, креатинина, остаточного азота мочевины или лактатдегидрогеназы.
Даже при отмене терапии, почечная недостаточность может оказаться необратимой и будет необходим гемодиализ.
У пациентов с раком легкого или метастазами в легкие повышен риск возникновения побочных эффектов со стороны системы дыхания. При появлении первых признаков пневмонита или появлении инфильтратов в легких лечение гемцитабином следует прекратить.
У пациентов, получавших гемцитабин в качестве монотерапии или в сочетании с другими химиотерапевтическими препаратами, был зарегистрирован синдром повышенной проницаемости капилляров. При обнаружении на ранних сроках и адекватных мерах, состояние обычно поддается лечению, но были зарегистрированы и смертельные случаи. Данное состояние характеризуется повышением проницаемости сосудов и переходом внутрисосудистой жидкости и белков в интерстициальное пространство. Клинические признаки включают генерализованные отеки, увеличение массы тела, гипоальбуминемию, выраженное снижение артериального давления, острую почечную недостаточность и отек легких. Если во время терапии гемцитабином развивается синдром повышенной проницаемости капилляров, необходимо прекратить применение гемцитабина и проводить поддерживающую терапию. Синдром повышенной проницаемости капилляров может развиться в более поздних циклах, в литературе описывается его связь с респираторным дистресс-синдромом. В ходе терапии гемцитабином выявляют связанные с введением препарата нарушения со стороны легких, в некоторых случаях тяжелой степени (такие как отек легких, интерстициальный пневмонит или острый респираторный дистресс-синдром). При развитии этих эффектов следует решить вопрос об отмене терапии гемцитабином. При раннем проведении поддерживающих мероприятий возможно улучшение состояния.
Оптимальный режим для безопасного введения гемцитабина в сочетании с терапевтическими режимами радиотерапии до настоящего времени не определен. Сопутствующая лучевая терапия (одновременно с введением гемцитабина или менее 7 дней до начала лечения) повышает риск развития лучевых реакций.
Из-за риска развития нарушений со стороны сердца и/или сосудов при применении гемцитабина следует соблюдать особую осторожность при лечении гемцитабином пациентов с заболеваниями сердечно-сосудистой системы.
Сообщалось о синдроме обратимой задней энцефалопатии (СОЗЭ) с потенциально тяжелыми последствиями у пациентов, принимающих гемцитабин в режиме монотерапии или совместно с другим и химиотерапевтическими средствами. У большинства пациентов с СЗОЭ на фоне применения гемцитабина сообщалось об остром повышении артериального давления и судорогах, однако данный синдром также может проявляться в виде головной боли, летаргии, спутанности сознания и слепоты. Диагноз достоверно подтверждается магнитно-резонансной томографией (МРТ). СЗОЭ обычно обратим в случае проведения соответствующих терапевтических мер. Если во время терапии развивается СЗОЭ, прием гемцитабина необходимо полностью прекратить и проводить поддерживающую терапию, в том числе контроль артериального давления, а также противосудорожную терапию.
Применение вакцины от желтой лихорадки и других живых ослабленных вакцин во время лечения гемцитабином не рекомендуется. Интервал между применением вакцин и окончанием лечения гемцитабином должен быть от 3 до 12 месяцев.
Мужчинам и женщинам детородного возраста во время лечения гемцитабином и, как минимум в течение 6 месяцев после, следует применять надежные методы контрацепции. В исследованиях по фертильности гемцитабин вызывал гипосперматогенез у самцов мышей. Поэтому мужчинам, получающим гемцитабин. рекомендуют избегать незащищенных половых контактов в ходе применения препарата и до 6 месяцев после терапии, а также перед началом лечения воспользоваться методом криоконсервации спермы по причине вероятности бесплодия вследствие лечения гемцитабином.
В одном флаконе с 5 мл препарата содержится не более 3,675 мг (0,16 ммоль) натрия, во флаконе с 25 мл препарата — не более 20,0 мг (0.87 ммоль) натрия. Это следует учитывать при назначении препарата пациентам, соблюдающим диету с контролируемым содержанием натрия.
При работе с гемцитабином должны соблюдаться меры предосторожности:
В случае контакта гемцитабина с кожей или слизистыми оболочками тщательно промыть водой (слизистые оболочки) или водой с мылом (кожу). Растворение, разведение и введение препарата проводится обученным медицинским персоналом с соблюдением защитных мер (перчатки, маски, одежда и др.).
Влияние на способность управлять транспортными средствами и механизмами:
Из-за вероятности проявления побочных эффектов, таких как сонливость, головная боль, следует соблюдать осторожность при занятиях потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций.
При появлении описанных нежелательных явлений следует воздержаться от выполнения указанных видов деятельности.
Форма выпуска/дозировка:
Концентрат для приготовления раствора для инфузий, 40 мг/мл.
Упаковка:
По 5 мл (200 мг действующего вещества), 25 мл (1000 мг действующего вещества) во флаконы из бесцветного стекла тип I, укупоренные пробками резиновыми с обкаткой колпачками алюминиевыми с крышками пластиковыми.
1, 5 или 10 флаконов вместе с инструкцией по применению помещают в пачку картонную. 10, 30, 50 или 80 флаконов вместе с равным количеством инструкций по применению помещают в коробку картонную (для стационаров).
Условия хранения:
Хранить в защищенном от света месте при температуре от 2 до 8 °С в оригинальной упаковке (флаконы в пачке).
Хранить в недоступном для детей месте.
Специальные меры предосторожности при уничтожении неиспользованных лекарственных препаратов
Остатки препарата, все инструменты и материалы, которые использовались для приготовления растворов для инфузии гемцитабина, должны уничтожаться в соответствии со стандартной больничной процедурой утилизации отходов цитотоксических веществ, с учетом действующих нормативных актов уничтожения опасных отходов.
Срок годности:
2 года.
Не применять по истечении срока годности.
Условия отпуска
По рецепту
Производитель
ООО Фармэра, 390020, г. Рязань, пос. Элеватор, д. 4, Россия
Владелец регистрационного удостоверения/организация, принимающая претензии потребителей:
ООО «ИРВИН 2»
*Цены в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Политика, а равно и международные ограничения отражаются на рядовых пользователях интернета, даже если они считают себя абсолютно аполитичными.
Например, владельцы iPhone в России больше не могут пользоваться Apple Pay и покупать приложений в App Store. Летом 2025 года ситуация дошла до того, что пользователи из РФ не могут скачивать дистрибутив мессенджера WhatsApp для Windows и Mac. Самое абсурдное, что веб-версия мессенджера при этом в России прекрасно работает.
По словам специалистов, невозможность скачивания клиента WhatsApp может быть связана с блокировкой Роскомнадзором отдельных элементов инфраструктуры Meta (организация признана экстремистской в России). Иными словами, в России оказалась заблокирована служба, отвечающая за обновления WhatsApp.
Полезная информация о WhatsApp
Несмотря на странные ограничения, WhatsApp остается доступен для пользователей из России. Теперь приложение невозможно скачать с официального сайта, но оно доступно в Windows Store. Также у WhatsApp есть прекрасный онлайн-клиент, по функционалу сравнимый с официальной версией для ПК.
В самом худшем случае установочный файл клиента WhatsApp для Windows можно скачать на сторонних сайтах. Этот вариант мы не рекомендуем, так как с ним велик шанс нарваться на мошенников или компьютерный вирус.
| Вид ПО | мессенджер |
| Способы связи | текстовая, голосовая, видео, конференции |
| Платформы | Windows, MacOS, Android, iOS |
| Количество поддерживаемых языков | 40+, в том числе русский |
| Год выпуска | 2009 |
| Авторы | Брайан Экстон, Ян Кум |
| Владелец ПО | Meta Platforms Inc., США (организация признана экстремистской в России) |
Доступен ли WhatsApp в России в 2025 году
Да, доступен. Несмотря на то, что остальные сервисы Meta (организация признана экстремистской) в России ограничены, WhatsApp продолжает работать. Более того, жители РФ ничего не нарушают, используя WhatsApp для общения. Тем не менее в государственных организациях начали постепенно отказаться от этой программы. Например, учителям рекомендуют использовать мессенджер сервиса «Моя школа».
Установка WhatsApp на компьютер и ноутбук
Сейчас сложности могут возникнуть лишь с установкой WhatsApp на компьютер, поэтому в первую очередь рассмотрим именно этот пункт.
Установка из Microsoft Store
Этот метод подходит для пользователей, обладающих лицензионной версией Windows 8 и новее. Он позволяет установить WhatsApp через внутренний магазин приложений Windows.

Для установки нужно запустить Microsoft Store и в графе поиска написать WhatsApp. Первое же приложение в списке окажется нужной программой. После установки авторизуйтесь в WhatsApp для Windows через смартфон.
Web-версия WhatsApp
Для того, чтобы пользоваться WhatsApp совсем не обязательно устанавливать его на компьютер или ноутбук. Если у вас возникли сложности со скачиванием клиента для ПК, попробуйте интернет-версию WhatsApp1. В целом, она мало чем отличается от полноценной. Перед использованием сайта в нем надо авторизоваться.

Как активировать WhatsApp на компьютере и ноутбуке
Для того, чтобы активировать WhatsApp на компьютере, необходимо авторизоваться в версию для ПК через мобильный телефон. Сделать это просто.

В меню мобильного приложения выберите пункт «Настройки» и в верхнем правом углу нажмите на пиктограмму QR-кода. Выберите вкладку «Сканировать код» и наведите его на изображение, которое появляется при запуске WhatsApp-клиента для ПК.

Через несколько секунд клиенты WhatsApp на смартфоне и на компьютере синхронизируются.
Установка WhatsApp на смартфоны и планшеты
Как правило, установка WhatsApp на смартфоны и планшеты проходит в автоматическом режиме. Несмотря на ограничения Роскомнадзора, все приложения Meta (организация признана экстремистской в России) по-прежнему можно получить в App Store и Google Play. Также установочные файлы WhatsApp для Android доступны для скачивания на официальном сайте мессенджера.
Установка WhatsApp на iPhone и iPad
Для девайсов на iOS существует лишь один способ установить WhatsApp — через официальный магазин App Store.
Откройте приложение App Store и выберите в меню поиска WhatsApp. Нас интересует оригинальное приложение — WhatsApp Messenger. Нажмите на кнопку «Установить», а дальше все произойдет в автоматическом режиме. После установки программа предложит восстановить прошлые переписки из облачного хранилища (если они есть).

В App Store до сих пор нет приложения WhatsApp для iPad. Поэтому пользователям приходится использовать web-версию мессенджера2. Перед этим в ней нужно авторизоваться.
Установка WhatsApp на ОС Android
Пользователи Android могут получить WhatsApp двумя способами — через Google Play и официальный сайт мессенджера.
В первом случае необходимо открыть магазин приложений Google Play и набрать в поле поиска «WhatsApp». Установка мессенджера пройдет автоматически.

Во втором случае приложение можно установить, скачав последнюю версию apk-файла с официального сайта3. Этот вариант подойдет для смартфонов, в которых не установлен магазин приложений от Google.

Файл нужно скачать на компьютер, а затем передать на смартфон. После открытия неизвестного системе apk-файла смартфон заблокирует его и предложит вам включить установку программ из недостоверных источников. Согласитесь на это.
На Android-планшетах WhatsApp также придется запускать в виде веб-приложения4. Тестирование официально клиента для планшетов пока проходит в закрытом режиме.


Как активировать WhatsApp на смартфоне и планшете
Впервые запуская WhatsApp на смартфоне с iOS или Android, вы привязываете его к абонентскому номеру. Поэтому дальнейшая авторизация после установки будет проходить через СМС. После ввода уникального кода из сообщения вы активируете WhatsApp.
С планшетами все иначе. Приложений для планшетных компьютеров на Android или iPadOS в открытом доступе нет, поэтому владельцам девайсов приходится использовать веб-версию мессенджера. Авторизация в ней происходит через QR-код, который нужно отсканировать через функцию в настройках мобильной версии WhatsApp.
Простые решения сложных вопросов с ПО
Популярные вопросы и ответы
На вопросы о типовых проблемах с WhatsApp отвечает Айсылу Шамсутдинова, глава отдела продаж в Gupshup (крупнейший глобальный официальный партнер WhatsApp).
Как перенести историю сообщений WhatsApp с одного устройства на другое?
Восстановление историй сообщений в WhatsApp возможно в случае, если пользователем заблаговременно были создана резервная копия чатов. В последних версиях WhatsApp чаты автоматически копируются и сохраняются на телефоне пользователя. Также можно настроить создание резервных копий на Google Drive или iCloud (в зависимости от операционной системы устройства). Если пользователь переносит данные в рамках устройств с одной и той же ОС (Android или iPhone), то используя резервные копии, можно легко перенести данные практически без потерь.
Для успешного восстановления резервной копии с Google Drive, важно использовать тот же номер телефона, который использовался для создания резервной копии. Для iPhone — один и тот же iCloud.
Для переноса WhatsApp с Android на iPhone и наоборот нужно воспользоваться специальными приложениями, такими как «Перенос на iOS», Samsung Smart Switch или Google Data Transfer Tool.
При этом важно понимать, что пользователь сможет перенести информацию своего аккаунта, фото профиля, индивидуальные и групповые чаты, историю чатов, медиафайлы и настройки, а историю звонков или отображаемое имя перенести не получится.
Можно ли восстановить удаленные сообщения и вложения в WhatsApp?
Если предварительно была создана резервная копия (это обычно происходит автоматически), то удаленные сообщения восстановить можно. Для этого достаточно воспользоваться восстановлением резервной копии.
Если функция резервного копирования была отключена, то удаленные сообщения восстановить не получится.
Можно ли запретить людям не из списка контактов связываться со мной через WhatsApp?
Да, нежелательного собеседника можно заблокировать. Для этого нужно открыть чат с ним, нажать на просмотр контакта и в нижней части меню выбрать опцию «Заблокировать». Если вам досаждает бизнес-аккаунт, вы можете попросить их отписать вас от рассылки, либо выбрать опцию «Пожаловаться». В этом случае WhatsApp будет разбираться в ситуации и может заблокировать такого пользователя и запретить отправлять сообщения кому-либо.
Что делать, если в WhatsApp не загружаются фото?
Необходимо устранить первопричину. Их может быть несколько:
1. Слабое или отсутствует подключение к Интернету. Переподключитесь к сети или перезагрузите телефон, чтобы восстановить соединение.
2. Проверьте дату и время на вашем телефоне. Если они указаны неверно, у вашего устройства не получится получить доступ к серверам WhatsApp и скачать ваше фото.
3. Проверьте достаточно ли памяти на вашем устройстве.
Что делать, если WhatsApp перестал запускаться на смартфоне или ПК?
В большинстве случаев это связано с подключением к интернету. Прежде всего необходимо проверить, стабильное ли у вас подключение. Также восстановлению работы приложений может помочь перезагрузка устройства или обновление приложения WhatsApp на смартфоне или браузера на ПК для успешного запуска WhatsApp Web.
Получает ли WhatsApp доступ к конфиденциальным данным владельца смартфона или ПК?
Личные сообщения и переписки пользователей защищены сквозным шифрованием и недоступны никому, кроме них самих (в том числе и WhatsApp).
Помимо переписок WhatsApp получает доступ к информации и некоторым функциям смартфона. Например, это может быть информация о местоположении, доступ к списку контактов, календарю, фотографиям, микрофону и так далее. Эти доступы определяются при установке приложения. Поменять доступы можно в настройках позже, но это может привести к ограничению некоторых функций WhatsApp.
Источники
- https://web.whatsapp.com/
- https://web.whatsapp.com/
- https://www.whatsapp.com/android/
- https://web.whatsapp.com/
Гемцитабин Медак (Gemcitabine Medac) инструкция по применению
📜 Инструкция по применению Гемцитабин Медак
💊 Состав препарата Гемцитабин Медак
✅ Применение препарата Гемцитабин Медак
📅 Условия хранения Гемцитабин Медак
⏳ Срок годности Гемцитабин Медак
Препарат отпускается по рецепту
Входит в список «Жизненно необходимых и важнейших лекарственных
препаратов»
Температура хранения: от 2 до 25 °С
⚠️ Государственная регистрация данного препарата отменена
Описание лекарственного препарата
Гемцитабин Медак
(Gemcitabine Medac)
Основано на официально утвержденной инструкции по применению препарата и подготовлено для электронного издания справочника Видаль 2011 года, дата обновления: 2022.06.24
Владелец регистрационного удостоверения:
Код ATX:
L01BC05
(Гемцитабин)
Лекарственные формы
|
Препарат отпускается по рецепту |
Гемцитабин Медак |
Лиофилизат для приготовления раствора для инфузий 1.5 г: фл. 1 шт. рег. №: ЛП-000150 |
|
Лиофилизат для приготовления раствора для инфузий 1 г: фл. 1 шт. рег. №: ЛП-000150 |
||
|
Лиофилизат для приготовления раствора для инфузий 200 мг: фл. 1 шт. рег. №: ЛП-000150 |
Форма выпуска, упаковка и состав
препарата Гемцитабин Медак
Лиофилизат для приготовления раствора для инфузий белого или почти белого цвета.
Вспомогательные вещества: маннитол, натрия ацетата тригидрат, натрия гидроксид, хлористоводородная кислота.
Флаконы (1) — пачки картонные.
Лиофилизат для приготовления раствора для инфузий белого или почти белого цвета.
Вспомогательные вещества: маннитол, натрия ацетата тригидрат, натрия гидроксид, хлористоводородная кислота.
Флаконы (1) — пачки картонные.
Лиофилизат для приготовления раствора для инфузий белого или почти белого цвета.
Вспомогательные вещества: маннитол, натрия ацетата тригидрат, натрия гидроксид, хлористоводородная кислота.
Флаконы (1) — пачки картонные.
Фармакологическое действие
Противоопухолевое средство, антиметаболит группы аналогов пиримидина, подавляет синтез ДНК. Проявляет циклоспецифичность, действуя на клетки в фазах S и Gl/S. Метаболизируется в клетке под действием нуклеозидкиназ до активных дифосфатных и трифосфатных нуклеозидов. Дифосфатные нуклеозиды ингибируют действие рибонуклеотидредуктазы (единственного фермента, катализирующего образование дезоксинуклеозидтрифосфатов, необходимых для синтеза ДНК). Трифосфатные нуклеозиды способны встраиваться в цепочку ДНК (в меньшей степени РНК), что приводит к прекращению дальнейшего синтеза ДНК и запрограммированной гибели клетки (апоптоз).
Гемцитабин является также сильным радиосенсибилизирующим средством даже в концентрациях более низких, чем цитотоксические.
Фармакокинетика
Cmax гемцитабина (от 3.2 мкг/мл до 45.5 мкг/мл) достигается через 5 минут после окончания инфузий. Фармакокинетический анализ исследований с однократным и многократным введением доз показывает, что Vd в значительной степени зависит от пола. Связывание гемцитабина с белками плазмы незначительное.
В организме гемцитабин быстро метаболизируется под действием цитидиндезаминазы в печени, почках, крови и других тканях, в результате чего образуются гемцитабин моно-, ди- и трифосфаты (dFdCMP, dFdCDP и dFdCTP), из которых активными считаются dFdCDP и dFdCTP.
Гемцитабин быстро выводится из организма с мочой в основном в виде неактивного метаболита 2’-дезокси-2′, 2’-дифторуридина. Менее 10% введенной в/в дозы обнаруживается в моче в форме неизмененного гемцитабина. Системный клиренс, который колеблется примерно от 30 л/ч/м2 до 90 л/ч/м2, зависит от возраста и пола: скорость выведения у женщин примерно на 25% ниже, чем у мужчин; как у мужчин, так и у женщин скорость выведения снижается с возрастом.
T1/2 колеблется от 42 мин до 94 мин. При соблюдении рекомендованного режима дозирования полное выведение гемцитабина происходит в течение 5-11 ч от начала инфузии. При введении один раз в неделю гемцитабин не накапливается в организме.
Комбинированная терапия гемцитабином и паклитакселом. При совместном введении гемцитабина и паклитаксела фармакокинетика препаратов не изменяется.
Комбинированная терапия гемцитабином и карбоплатином. При совместном введении гемцитабина и карбоплатина фармакокинетика гемцитабина не изменяется.
Нарушение функции почек. Почечная недостаточность легкой или умеренной степени (клиренс креатинина 30-80 мл/мин) не оказывает существенного влияния на фармакокинетику гемцитабина.
Показания препарата
Гемцитабин Медак
- местно-распространенный или метастатический немелкоклеточный рак легкого в качестве терапии первой линии в комбинации с цисплатином, а также в монотерапии у пожилых пациентов с функциональным статусом, равным 2;
- нерезектабельный, местно-рецидивирующий или метастатический рак молочной железы в составе комбинированной терапии с паклитакселом после проведения неоадъювантной и/или адъювантной терапии с включением антрациклинов при отсутствии противопоказаний к их назначению;
- местно-распространенный или метастатический уротелиальный рак (рак мочевого пузыря, почечной лоханки, мочеточников, уретры);
- местно-распространенный или метастатический эпителиальный рак яичников в качестве монотерапии или в сочетании с карбоплатином у пациентов с прогрессированием заболевания после проведения первой линии терапии на основе платиносодержащих препаратов;
- местно-распространенный или метастатический рак поджелудочной железы;
- местно-распространенный или метастатический рак шейки матки.
Режим дозирования
Гемцитабин вводится в/в капельно в течение 30 минут.
Немелкоклеточный рак легкого
Монотерапия: рекомендуемая доза препарата — 1000 мг/м2 в 1, 8 и 15 дни каждого 28-дневного цикла.
Комбинированная терапия с цисплатином: рекомендуемая доза препарата — 1250 мг/м2 в 1 и 8 день каждого 21-дневного цикла или 1000 мг/м2 в 1, 8 и 15 дни каждого 28-дневного цикла Цисплатин вводится в дозе 70-100 мг/м2 в 1-й день цикла на фоне водной нагрузки после инфузии гемцитабина.
Комбинированная терапия с карбоплатином: рекомендуемая доза препарата — 1000 мг/м2 или 1200 мг/м2в 1 и 8 день каждого 21-дневного цикла. Карбоплатин вводится в дозе AUC 5.0 мг/мл×мин в 1-й день цикла после инфузии гемцитабина.
Рак молочной железы
Комбинированная терапия: в качестве терапии 1-й линии при прогрессировании заболевания посте неоадъювантной терапии, включающей антрациклины; рекомендуемая доза препарата — 1250 мг/м2 в 1-й и 8-й дни в сочетании с паклитакселом в дозе 175 мг/м2, который вводится в 1-й день каждого 21-дневного цикла в/в капельно примерно в течение 3 ч, перед введением гемцитабина.
Уротелиальный рак
Монотерапия: рекомендуемая доза препарата — 1250 мг/м2 в 1, 8 и 15 дни каждого 28-дневного цикла.
Комбинированная терапия: рекомендуемая доза препарата — 1000 мг/м2 в 1-й, 8-й и 15-й дни в сочетании с цисплатином, который вводится в дозе 70 мг/м2 сразу после инфузии гемцитабина в 1-й или во 2-й день каждого 28-дневного цикла.
Эпителиальный рак яичников
Монотерапия: рекомендуемая доза препарата — 800-1250 мг/м2 в 1-й, 8-й и 15-й дни каждого 28-дневного цикла.
Комбинированная терапия: рекомендуемая доза препарата — 1000 мг/м2 в 1-й и 8-й дни в сочетании с карбоплатином в дозе AUC4.0 мг/мл×мин, который вводится сразу после инфузии гемцитабина в 1-й день каждого 21-дневного цикла.
Рак поджелудочной железы
Монотерапия:рекомендуемая доза препарата — 1000 мг/м2 1 раз в неделю в течение 7 недель с последующим недельным перерывом. Затем препарат вводится в 1-й, 8-й и 15-й дни каждого 28-дневного цикла.
Рак шейки матки (местно-распространенный или метастатический)
Комбинированная терапия: При местно-распространенном раке (неоадъювантно) и при метастатическом раке гемцитабин вводится в дозе 1250 мг/м2 в 1-й и 8-й дни каждого 21-дневного цикла. Цисплатин вводится в дозе 70 мг/м2 посте введения гемцитабина в 1-й день цикла на фоне гипергидратации.
Корректор дозы препарата в связи с явлениями гематологической токсичности
Начало цикла лечения
Независимо от показаний, перед каждым введением препарата необходимо оценивать чисто тромбоцитов и гранулоцитов.
Условием начала лечения является абсолютное количество нейтрофилов не менее 1500/мкл и количество тромбоцитов не менее 100000/мкл.
В случае развития гематологической токсичности во время проведения цикла терапии доза гемцитабина может быть уменьшена, либо ее введите отложено в соответствии со следующими рекомендациями:
* При увеличении количества нейтрофилов до 500/мкл и тромбоцитов до 50000/мкл введение гемцитабина может быть продолжено в рамках цикла
* Лечение в рамках цикла не возобновляется. Очередное введение гемцитабина проводится в 1-й день очередного цикла при восстановлении количества нейтрофилов как минимум до 1500/мкл и тромбоцитов до 100000/мкл
* Лечение в рамках цикла не возобновляется. Очередное введение гемцитабина проводится в 1 день очередного цикла при достижения количества нейтрофилов как минимум до 1500/мкл и тромбоцитов до 100000/мкл
Доза гемцитабина на очередном цикле должна быть уменьшена на 25% при всех показаниях в случаях, если при предыдущем цикле наблюдалось:
- снижение абсолютного чиста нейтрофилов < 500/мкл, продолжающееся более 5 дней;
- снижение абсолютного числа нейтрофилов < 100/мкл, продолжающееся более 3 дней;
- фебрильная нейтропения;
- снижение чиста тромбоцитов < 25000/мкл;
- цикл был отложен более чем на 1 неделю из-за гематологической токсичности.
Коррекция дозы препарата в связи с явлениями негематологической токсичности
Для выявления негематологической токсичности должны проводиться периодический физикальный осмотр и контроль функций печени и почек. Доза препарата может быть уменьшена в каждом последующем цикле или в течение уже начатого цикла в зависимости от степени проявления токсичности препаратов, назначенных пациенту. В случае тяжелой (3 или 4 степень) негематологической токсичности, за исключением случаев тошноты/рвоты, терапию гемцитабином следует приостановить или снизить величину дозировки в зависимости от решения лечащего врача. Решение о возобновлении лечения принимает врач.
Способ введения
Инфузионное введение гемцитабина обычно хорошо переносится пациентами и может проводиться в амбулаторных условиях. В случае экстравазации инфузию прекращают и возобновляют введение препарата в другую вену. После введения гемцитабина пациент должен наблюдаться в течение некоторого времени.
Особые группы пациентов
Пациенты с нарушением функции печени и почек: применять гемцитабин у больных с печеночной недостаточностью или с нарушенной функцией почек следует с осторожностью, так как достаточных данных по применению препарата у этой категории пациентов нет. Почечная недостаточность умеренной или средней тяжести (скорость клубочковой фильтрации от 30 мл/мин до 80 мл/мин) не оказывает заметного влияния на фармакокинетику гемцитабина
Пожилые пациенты (> 65 лет): гемцитабин хорошо переносится пациентами старше 65 лет. Специфические рекомендации по изменению дозы препарата для данной популяции отсутствуют.
Дети (< 18 лет): гемцитабин не рекомендуется назначать детям в возрасте до 18 лет в связи с недостаточной информацией по безопасности и эффективности препарата в данной популяции.
Рекомендации по приготовлению раствора для инфузий
В качестве растворителя используется только 0.9% раствор натрия хлорида без консервантов.
Для приготовления раствора препарата во флакон медленно вводят необходимое количество 0.9% раствора натрия хлорида для инъекций (не менее количества, указанного в таблице ниже) и аккуратно встряхивают флакон до полного растворения содержимого.
Полученный раствор должен быть прозрачным.
Максимальная концентрация восстановленного раствора гемцитабина не должна превышать 38 мг/мл, так как при более высоких концентрациях возможно неполное растворение препарата.
Приготовленный раствор гемцитабина, содержащий нужную дозу препарата, перед введением разбавляют 0.9 % раствором натрия хлорида для инъекций в количестве, достаточном для 30-минутной в/в инфузии.
Перед парентеральным введением раствора препарата следует убедиться в отсутствии в нем нерастворенных частиц и изменения цвета раствора
Приготовленный раствор препарата предназначен только для однократного применения.
Весь неиспользованный препарат должен быть утилизирован.
Побочное действие
Побочные реакции, встречавшиеся чаще, чем в единичных случаях, перечислены в соответствии со следующей градацией: очень часто (> 10%); часто (> 1% до < 10%); нечасто (> 0.1% до < 1%); редко (> 0.01% до < 0.1%); очень редко (< 0.01%).
Со стороны органов кроветворения: часто — лейкопения, нейтропения, тромбоцитопения, анемия; часто — фебрильная нейтропения; очень редко — тромбоцитоз.
Со стороны системы пищеварения: очень часто — тошнота, рвота, повышение активности «печеночных» трансаминаз (АСТ, АЛТ), щелочной фосфатазы; часто — анорексия, диарея, запор, стоматит, повышение концентрации билирубина; редко — повышение активности ГГТ; частота не может быть оценена на основании имеющихся данных — ишемический колит, токсическое поражение печени, включая печеночную недостаточность с летальным исходом.
Со стороны мочевыделительной системы: очень часто — гематурия и протеинурия легкой степени; частота не может быть оценена на основании имеющихся дачных — острая почечная недостаточность, клинические признаки и симптомы, схожие с гемолитико-уремическим синдромом (снижение гемоглобина, тромбоцитопения, увеличение содержания билирубина, креатинина, мочевины и/или ЛДГ в сыворотке крови).
Со стороны кожи и кожных придатков: очень часто — кожные высыпания, сопровождающиеся зудом, алопеция; часто — кожный зуд, повышенная потливость; редко — изъязвления, образование пузырей, очень редко — выраженные кожные реакции, включая десквамацию и буллезные высыпания; частота не может быть оценена — синдром Лайелла, синдром Стивенса-Джонсона.
Со стороны дыхательной системы: очень часто — одышка; часто — кашель, ринит, нечасто -бронхоспазм, интерстициальная пневмония; частота не может быть оценена — отек легкого, острый респираторный дистресс-синдром.
Со стороны сердечно-сосудистой системы: редко — снижение артериального давления, инфаркт миокарда, частота не может быть оценена — аритмия (в основном суправентрикулярная), сердечная недостаточность, клинические признаки периферического васкулита и гангрены.
Со стороны нервной системы: часто — головная боль, повышенная сонливость, бессонница; частота не может быть оценена — инсульт.
Прочие: очень часто — чувство недомогания, гриппоподобный синдром, периферические отеки; часто — повышение температуры тела, озноб, астения, боли в спине, миалгия; редко — отечность лица, реакции в месте введения; очень редко — анафилактические реакции.
Противопоказания к применению
- повышенная чувствительность к активному веществу или к любому из вспомогательных веществ;
- беременность и период кормления грудью;
- детский возраст до 18 лет (отсутствие достаточных данных по эффективности и безопасности).
С осторожностью: при нарушении функции печени и/или почек, угнетении костномозгового кроветворения (в том числе на фоне сопутствующей лучевой или химиотерапии), сердечно-сосудистых заболеваниях в анамнезе, при метастатическом поражении печени, гепатите, алкоголизме, при одновременно проводимой лучевой терапии, острых инфекционных заболеваниях вирусной, грибковой или бактериальной природы (в том числе ветряной оспе, опоясывающем лишае).
Применение при беременности и кормлении грудью
Противопоказан: беременность и период кормления грудью.
Применение при нарушениях функции печени
С осторожностью при нарушении функции печени, при метастатическом поражении печени, гепатите. Во время лечения необходимо проводить регулярное обследование больного и оценку функции печени. Введение гемцитабина при метастазах в печени, при гепатите и алкоголизме в анамнезе, а также при циррозе печени увеличивает риск развития печеночной недостаточности.
Применение при нарушениях функции почек
С осторожностью при нарушении функции почек. Во время лечения необходимо проводить регулярное обследование больного и оценку функции почек.
Применение у детей
Противопоказан детям до 18 лет (отсутствие достаточных данных по эффективности и безопасности).
Применение у пожилых пациентов
Препарат хорошо переносится пациентами старше 65 лет. Специфические рекомендации по изменению дозы препарата для данной популяции отсутствуют.
Особые указания
Лечение гемцитабином можно проводить только под наблюдением врача, имеющего опыт применения противоопухолевой химиотерапии.
Перед каждым введением гемцитабина необходимо контролировать количество тромбоцитов, лейкоцитов и гранулоцитов в крови. При признаках угнетения функции костного мозга, вызванного препаратом, необходимо приостановить лечение или скорректировать дозу.
Обычно подавление функции костного мозга носит краткосрочный характер, не требует снижения дозы и редко приводит к необходимости прерывания лечения. Показатели периферической крови могут продолжать ухудшаться после прерывания терапии гемцитабином.
При применении гемцитабина в комбинации с другими противоопухолевыми химиопрепаратами необходимо учитывать риск кумулятивного подавления функции костного мозга.
Необходимо проводить регулярное обследование больного и оценку функции почек и печени.
Введение гемцитабина при метастазах в печени, при гепатите и алкоголизме в анамнезе, а также при циррозе печени увеличивает риск развития печеночной недостаточности. При появлении признаков развития нежелательных явлений со стороны дыхательной системы (например, отек легких, интерстициальный пневмонит или респираторный дистресс-синдром у взрослых) на фоне лечения гемцитабином лечение следует прекратить и назначить соответствующую терапию.
При появлении первых признаков микроангиопатической гемолитической анемии, таких как быстрое снижение гемоглобина с сопутствующей тромбоцитопенией, повышение сывороточной концентрации билирубина, креатинина, азота мочевины или повышение активности ЛДГ, гемцитабин должен быть отменен.
Увеличение длительности инфузии и частоты введений приводит к возрастанию токсичности.
Риск кожных реакций возрастает при наличии лучевой терапии в анамнезе.
В зависимости от степени токсичности дозу можно снижать в ходе каждого цикла или с началом нового цикла ступенчато.
Во время лечения и в течение 6-и месяцев после окончания терапии гемцитабином следует использовать надежные методы контрацепции. Мужчинам, получающим гемцитабин, рекомендуется прибегнуть к криоконсервации спермы до начала лечения в связи с риском бесплодия, обусловленным применением данного препарата
При лечении пациентов, находящихся на контролируемой натриевой диете следует учитывать содержание в препарате натрия в следующих количествах:
флакон 200 мг Гемцитабина медак содержит 3.5 мг (< 1 ммоль) натрия,
флакон 1000 мг Гемцитабина медак содержит 17.5 мг (< 1 ммоль) натрия,
флакон 1500 мг Гемцитабина медак содержит 26.3 мг (< 1 ммоль) натрия.
Влияние на способность управлять транспортным средством и работать с механизмами. Данные о влиянии терапии гемцитабином на способность управлять транспортным средством и работать с механизмами отсутствуют, однако, некоторые побочные действия препарата такие как повышенная сонливость, могут отрицательно влиять на способность выполнять такие действия. В период лечения гемцитабином необходимо соблюдать осторожность при управлении транспортными средствами и занятии потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций.
Передозировка
Симптомы: миелодепрессия, парестезия, выраженная кожная сыпь. При введении гемцитабина в дозах до 5700 мг/м2 в/в капельно за 30 минут каждые 2 недели признаков передозировки не наблюдалось. Антидот для гемцитабина неизвестен.
При подозрении на передозировку гемцитабина следует контролировать степень цитопении и при необходимости назначить симптоматическую терапию.
Лекарственное взаимодействие
Специфических исследований взаимодействий гемцитабина не проводилось.
Лучевая терапия
Сопутствующая лучевая терапия (одновременно с введением гемцитабина или с интервалом < 7 дней до начала лечения): в данной ситуации токсичность лечения зависит от многих факторов, включая дозу гемцитабина и частоту его введения, дозу излучения, метод лучевой терапии, характер облучаемой ткани и ее объем. Было показано, что гемцитабин обладает радиосенсибилизирующее активностью. В одном исследовании, где пациенты с немелкоклеточным раком легкого получали гемцитабин в дозе 1000 мг/м2 на протяжении 6 последовательных недель в сочетании с терапевтическим облучением на область грудной клетки, была отмечена значительная токсичность, в виде тяжелого и потенциально угрожающего жизни воспаления слизистой оболочки, главным образом эзофагита и пневмонита, особенно у пациентов с большим объемом облучения тканей (медиана объема облучаемой ткани 4795 см3). В последующих исследованиях было показано, что сочетание более низких доз гемцитабина и лучевой терапии лучше переносится пациентами и характеризуется предсказуемым профилем токсичности. Так, в одном из исследований II фазы пациентам с немелкоклеточным раком легкого проводилась лучевая терапия в дозе 60 Гр совместно с введением гемцитабина (600 мг/м2 4 раза) и цисплатина (80 мг/м2 2 раза) на протяжении 6 недель.
Последовательная терапия (перерыв > 7 дней): по существующим данным, введение гемцитабина более чем за 7 дней до начала лучевой терапии или более чем через 7 дней после се завершения не сопровождается увеличением токсичности, за исключением поражения кожи, связанного с введением химиопрепарата после облучения. Лечение гемцитабином может быть начато через 7 дней после облучения или после разрешения всех острых лучевых реакций.
Как при сопутствующем, так и при последовательном применении гемцитабина и лучевой терапии возможно лучевое поражение облучаемых тканей (напр., эзофагит, колит и пневмонит).
Иммунодепрессанты (азатиоприн, хлорамбуцил, глюкокортикостероиды, циклофосфамид, циклоспорин, меркаптопурин) увеличивают риск развития инфекций.
Другие виды взаимодействия
При одновременном применении с живыми вирусными вакцинами возможна интенсификация процесса репликации вакцинного вируса усиление его побочных/неблагоприятных эффектов и/или снижение выработки антител в организме больного в ответ на введение вакцины. Поэтому из-за риска системных, возможно летальных осложнений, особенно у больных со сниженным иммунным статусом, интервал между применением гемцитабина и таких вакцин должен быть не менее 3 месяцев или более (до 12 месяцев) в зависимости от иммунного статуса больного.
Исследования совместимости гемцитабина не проводились. Нельзя смешивать гемцитабин с другими лекарственными препаратами.
Условия хранения препарата Гемцитабин Медак
В защищенном от света месте при температуре не выше 25°С. Хранить в недоступном для детей месте!
Срок годности препарата Гемцитабин Медак
Срок годности. 2.5 года Не использовать по истечении срока годности, указанного на упаковке.
Условия реализации
Препарат отпускается по рецепту.
Адрес производителя
|
ONCOTEC PHARMA PRODUKTION , GmbH |
Германия |
Am Pharmapark, 06861 Dessau-Rosslau,Germany |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Аналоги препарата
-
Гемзар®
(СВИКС ХЭЛСКЕА, Россия) -
Гемита
(FRESENIUS KABI DEUTSCHLAND, Германия) -
Гемтаз
(SUN PHARMACEUTICAL INDUSTRIES, Индия) -
Гемтакс®онко
(HETERO LABS, Индия) -
Гемцивин
(ФАРМАСИНТЕЗ-НОРД, Россия) -
Гемцитабин
(ФАРМЭРА, Россия) -
Гемцитабин
(АРС, Россия) -
Гемцитабин
(БЕЛМЕДПРЕПАРАТЫ, Республика Беларусь) -
Гемцитабин-Амедарт
(АМЕДАРТ, Россия) -
Гемцитабин-Келун-Казфарм
(Келун–Казфарм, Казахстан)
Все аналоги
WhatsApp — один из самых популярных сервисов для общения. Он надежен, имеет обширный функционал для работы и прост в обращении, им ежемесячно активно пользуются более 2 миллиардов человек по всему миру. В нашей статье мы подробно расскажем, как скачать и установить WhatsApp в 2025 году.
На телефон
На компьютер
Что стоит запомнить
На телефон
На компьютер
Что стоит запомнить
Сервис WhatsApp появился в 2009 году благодаря бывшим сотрудникам Yahoo! Яну Куму и Брайану Эктону. На протяжении 15 лет он постоянно совершенствуется, обзаводясь новыми возможностями (рекомендуем ознакомиться с нашим материалом «15 опций WhatsApp, о которых вы могли не знать»). Сейчас это одно из наиболее удобных приложений для общения как с друзьями, так и для решения задач по работе.
В WhatsApp пользователи могут вести переписку, совершать звонки, обмениваться фото, видео и файлами, обсуждать важные моменты в чатах. В групповых чатах может участвовать до 1024 человек, а совместные видеозвонки поддерживают до 32 человек одновременно. Это делает сервис отличным инструментом для общения в больших коллективах.
В этой статье мы рассмотрим, как скачать и установить WhatsApp в 2025 году на различных устройствах. Информация актуальная для владельцев смартфонов, планшетов и ПК.
Пошаговая инструкция, как скачать новый WhatsApp на телефон
Приложение WhatsApp распространяется бесплатно и свободно доступно в России. Загрузить мобильную версию на смартфон или планшет можно с сервисов цифровой дистрибуции Google Play, App Store или официального сайта разработчиков. Ниже рассмотрим все эти способы.
Способы установки WhatsApp на Android
Приложение WhatsApp для смартфонов и планшетов на Android можно установить через Google Play или с официального сайта разработчиков. Рассмотрим пошагово, как это сделать.
Через Google Play
Владельцы мобильных устройств на базе Android могут воспользоваться магазином Google Play. Для этого нужно выполнить следующие действия:
- Откройте на смартфоне или планшете сервис Google Play.
- В поисковой строке напишите запрос «WhatsApp» и перейдите на вкладку с мессенджером.
- Нажмите кнопку «Установить» и дождитесь полной загрузки и установки приложения на ваше устройство.

С официального сайта
Владельцы мобильных устройств без Google Play или с альтернативными магазинами приложений, в которых отсутствует WhatsApp, могут скачать и установить мессенджер с сайта разработчиков. Например, это актуально для пользователей со смартфонами Samsung Galaxy и Huawei.
Чтобы установить WhatsApp с сайта, выполните следующие действия:
- Откройте браузер и перейдите на страницу для загрузки официальной версии для Android по этой ссылке.
- Выберите вариант «Скачать WhatsApp напрямую».
- Скачайте APK-файл и затем установите его на своем устройстве, выбрав из списка загрузок.
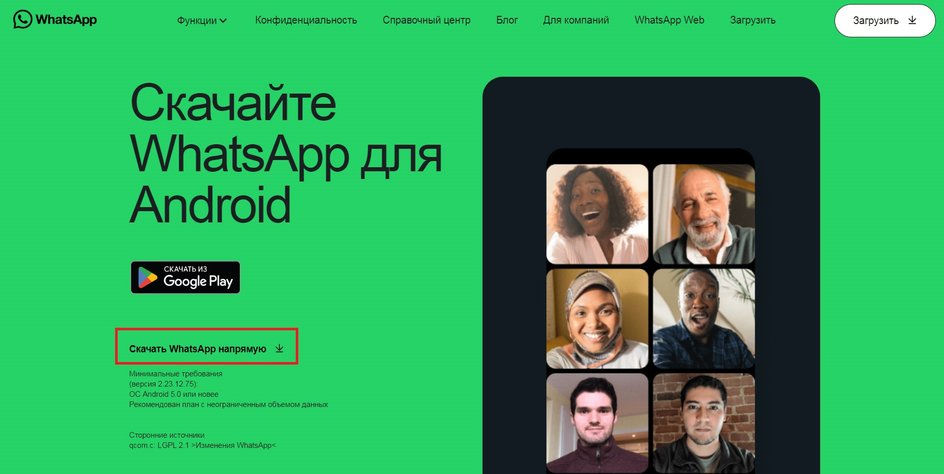
Способы установки WhatsApp на iOS
Единственный способ установить WhatsApp на мобильные устройства компании Apple — воспользоваться официальным магазином App Store. Для этого выполните нижеприведенные действия:
- Зайдите в сервис App Store.
- С помощью поисковика найдите официальное приложение WhatsApp.
- Нажмите кнопку «Установить». Приложение загрузится и установится на вашем устройстве автоматически.
Отметим, что этот способ актуален только для iPhone. На планшетах iPad нет приложения WhatsApp (пока доступно только в бета-версии), поэтому нужно использовать браузерную версию мессенджера.
Способы установки WhatsApp на часы Apple Watch
Официального приложения WhatsApp для часов Apple Watch нет. Владельцы смартфонов iPhone могут лишь в настройках мессенджера активировать функцию получения уведомлений на Apple Watch.
Однако для использования WhatsApp на Apple Watch можно установить сторонние приложения. Например, Chatify или WatchChat 2. Они позволяют просматривать и отвечать на сообщения, присланные в WhatsApp непосредственно на смарт-часах.
Рассмотрим, как начать пользоваться WhatsApp на Apple Watch с помощью приложения WatchChat 2:
- Используя iPhone, зайдите в сервис App Store и скачайте приложение WatchChat 2.
- Установите и откройте приложение WatchChat 2 на часах Apple Watch.
- Откройте приложение WhatsApp на iPhone.
- В приложении WhatsApp на iPhone зайдите в раздел «Настройки», далее выберите функцию «WhatsApp Web» и нажмите на «Сканировать QR-код».
- Отсканируйте QR-код, который появится на экране Apple Watch.
После этого приложение WhatsApp будет синхронизировано с WatchChat 2 и станет возможно просматривать и отправлять сообщения непосредственно с Apple Watch.
Проверенные способы установить WhatsApp на компьютере
Мессенджером WhatsApp можно пользоваться не только на мобильных устройствах, но еще и на компьютерах и ноутбуках на базе операционных систем Windows и macOS. Пользователям доступен как официальный клиент для ПК, так и браузерная версия приложения.
Скачать и установить приложение
- Скачайте установочный файл (с расширением .exe) с официального сайта WhatsApp по ссылке.
- Установите приложение, следуя простым инструкциям на экране.

Приложение из Microsoft Store для Windows
- Зайдите в сервис Microsoft Store через браузер.
- Установите официальное приложение WhatsApp по этой ссылке.
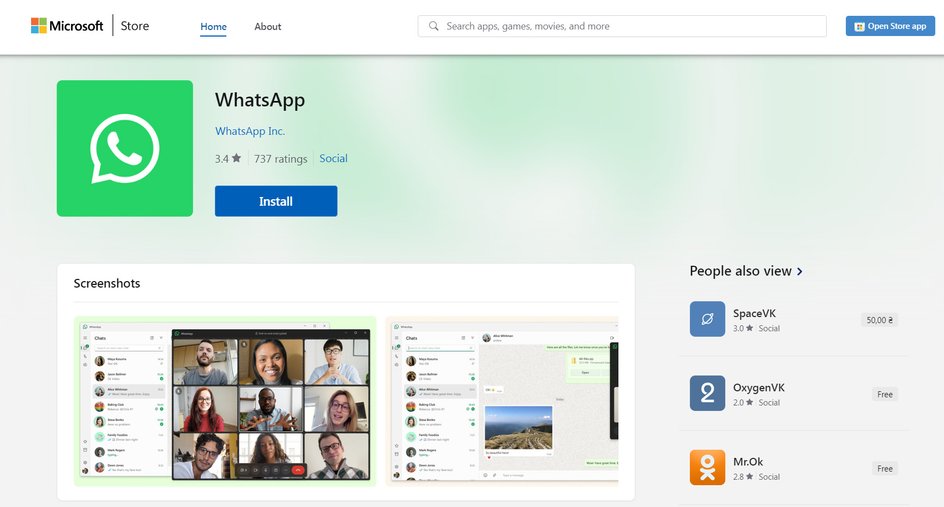
Приложение из Mac App Store для Mac
- Зайдите в сервис Mac App Store на вашем компьютере.
- Найдите и установите официальное приложение WhatsApp.
Обратите внимание, что в десктопной версии WhatsApp нет возможности регистрации и авторизации непосредственно с компьютера. Чтобы зайти в приложение и начать работать, придется авторизоваться со смартфона или планшета. Это обязательное требование, и других вариантов нет. Чтобы программа заработала, необходимо сделать следующее:
- Откройте приложение WhatsApp на компьютере. На экране появится QR-код.
- Откройте приложение WhatsApp на смартфоне или планшете. Перейдите в раздел «Меню», если это версия для Android или в «Настройки», если это адаптация для iOS.
- Выберите пункт «Связанные устройства», затем «Привязать устройство» и отсканируйте камерой смартфона QR-код на экране компьютера.
После этого приложения синхронизируются, и можно будет пользоваться WhatsApp на компьютере.
Использование web-версии WhatsApp
Мессенджер WhatsApp имеет браузерную версию. Она отлично подойдет, если не хватает памяти на смартфоне или нужно оперативно воспользоваться приложением на стороннем устройстве. Запускается web-версия следующим образом:
- В любом удобном браузере откройте ссылку web.whatsapp.com.
- Отсканируйте QR-код камерой через приложение на смартфоне, как это описано в случае с клиентом для ПК, либо введите свой номер телефона и затем используйте проверочный код для авторизации.
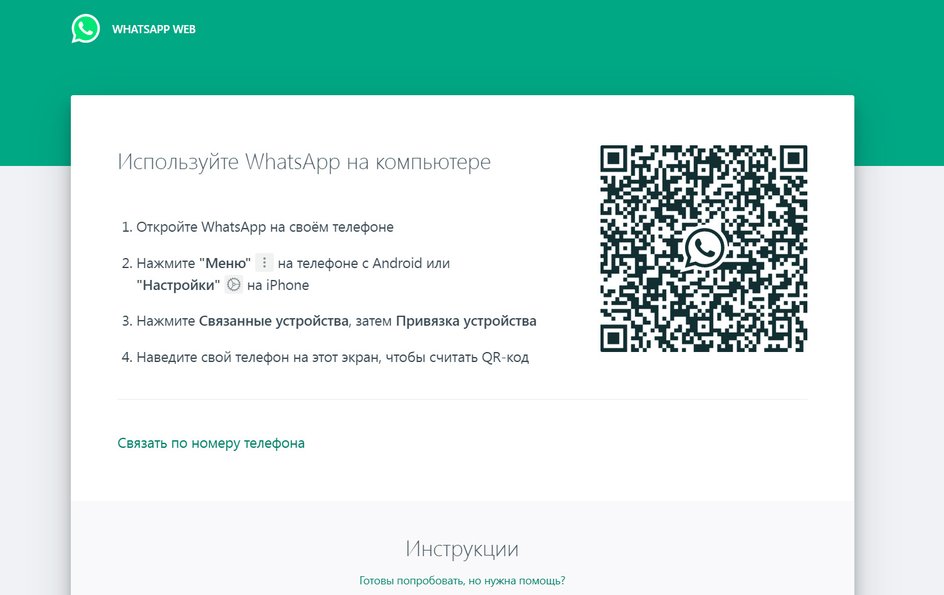
Web-версия мессенджера WhatsApp имеет урезанный функционал. В частности, пользователи не могут совершать голосовые и видеозвонки. Кроме того, общаться можно только в уже существующих чатах. Начать новый диалог нельзя.
Что стоит запомнить пользователю об установке и использовании WhatsApp на различных устройствах
- Мессенджер WhatsApp доступен в виде официального приложения для мобильных устройств на базе Android и iOS, а также для PC и Mac.
- Официальной версии WhatsApp для Apple Watch нет, но можно воспользоваться сторонними приложениями для синхронизации мессенджера с часами.
- Версия WhatsApp для компьютера работает на операционных системах Windows 10 и выше или macOS 11.0 Big Sur.
- На компьютерах и ноутбуках можно использовать браузерную версию WhatsApp. Однако для авторизации в ней все равно придется воспользоваться телефоном, отсканировав QR-код через мобильное приложение или введя проверочный код, присланный на указанный номер телефона.
- Браузерная версия WhatsApp имеет урезанный функционал, поэтому лучше скачать и использовать специальный клиент для ПК.
